APT-weighted MRI: Technique And Challenging Issues
تصویربرداری وزن APT یک تکنیک تصویربرداری مولکولی MRI است که کنتراست تصویر را بر اساس پروتون های آمید موجود در پپتیدها و پروتیین های سلولی متحرک درون بافت و اندوژن فراهم می کند. این تکنیک از روش های تصویربرداری CEST است که بیشترین میزان تحقیق را در این زمینه به خود اختصاص داده است که به صورت موفقیت آمیزی برای تصویربرداری از محتوای پروتیینی و pH بافت ها مورد استفاده قرار گرفته است. توانایی این تکنیک در اندازه گیری pH به دلیل وابستگی زیاد آهنگ تعویض پروتون آمید به میزان pH است.
با استفاده از تصویربرداری جابجایی پروتون آمید، این پروتیین ها را می توان با استفاده از سیگنال آب به تصویر کشید، بنابراین امکان اضافه شده آن به اسکنرهای بالینی MRI وجود دارد. هنگامی که از روش استاندارد پردازش آنالیز CEST استفاده می شود، تصاویر دارای سیگنال های اضافی هستند که امکان توصیف این میزان سیگنال اضافی در تصویربرداری وزن APT بیشتر است.
APTw MRI Principles And Techniques
Basic Principles
اساس حساسیت در تصویربرداری APTw در شکل 1-a شرح داده شده است. مولکول های حل شده با غلظت های پایین به صورت انتخابی به وسیله ی پروتون های قابل تعویض اشباع کننده ی ویژه ( مانند آمید، آمین، ایمینو، یا پروتون های هیدروکسیل)، با استفاده از تابش RF علامت گذاری می شوند. هنگامی که این پروتون های علامت گذاری و اشباع شده با پروتون های آب جایگزین می شوند، سیگنال آب به مقدار اندکی کاهش می یابد. در نگاه به محلول با غلظت پایین (غلظت در محدوده ی میکرو تا میلی مولار) جابجایی تنها یک پروتون اشباع شده برای نمایش اثر آن بی فایده است. با اینحال به دلیل اینکه مقدار آب موجود بسیار بیشتر از پروتون های حل شوند است، هر یک از این پروتون ها مجددا اشباع شده و سبب افزایش اثر اشباع می گردند. اگر آهنگ جابجایی پروتون های حل شونده و آب به مقدار موثری بیاشد (ده ها هرتز) و اگر مقدار T1 حلال (آب) به میزان موثری بالا باشد، تابش طولانی مدت پالس RF سبب انهنسمنت قابل توجهی در می گردد. مقدار اثر CEST به وسیله ی آهنگ جابجایی پروتون (PTR) بیان می گردد. بر اساس مدل جابجایی بین دو مخزن پروتون مقدار PTR برای آمید با استفاده از فرمول 1 محاسبه می شود:
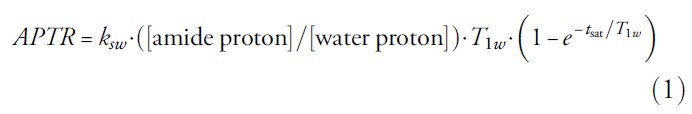
جذر براکت ها نشان دهنده ی غلظت (2*55/6= غلظت آب) و t(sat) (زمان سرکوب) زمانی است بین اعمال پالس سرکوب و ایجاد جابجایی. اگرچه اغلب پروتیین ها و پپتید های موجود در بافت دارای غلظتی در محدوده ی میکرومولار هستند اما آن ها سامل چندین پروتون آمید می باشند. همچنین بسیاری از پروتون ها و پپتیدها می توانند ذر ارتباط با گروه های آمید به صورت in vivo دارای فرکانسی یکسان هستند که سبب ایجاد رزونانس ترکیبی بزرگی می گردند که غلظت پروتونی در حدود 50 تا 100 میلی مولار می شوند.
شکل 1
APTw MRI-Related Metrics
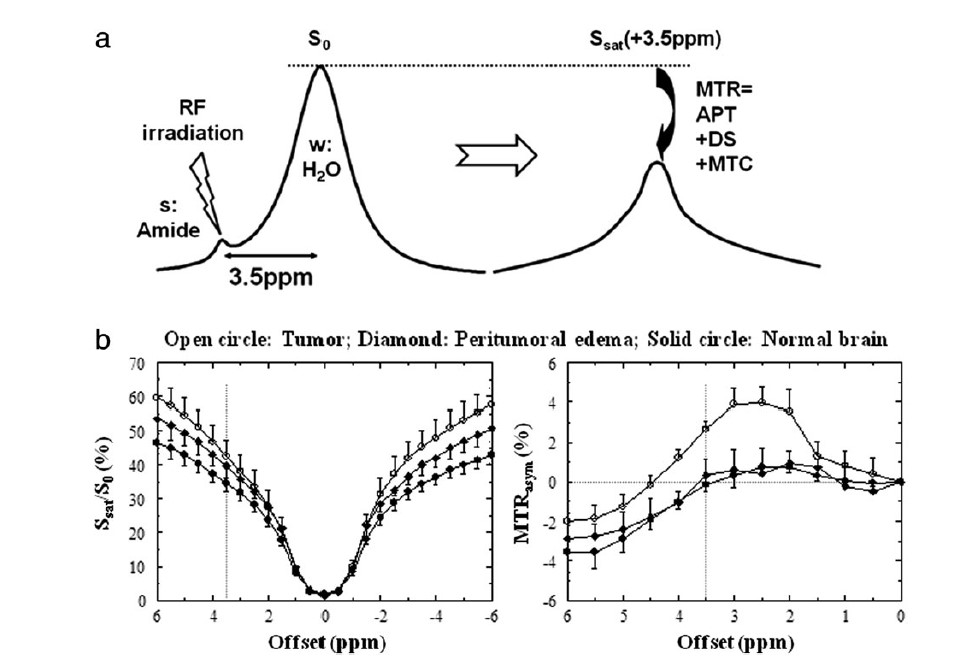
اثرات CEST معمولا به وسیله ی پارامتری که طیف Z نامیده می شود ارزیابی می گردند. طیف Z نشاندهنده ی سیگنال آب در یک آشفتگی فرکانسی (∆ꙍ) است، سیگنال(∆ꙍ)S (sat) ، که سیگنال نرمالیزه شده بدون سرکوب( s0 ) است، به عنوان تابعی از فرکانس تابشی با استفاده از فرکانس آب به عنوان مرجع (0) نمایش داده شده است(شکل 1-b). هنگام انجام یک آزمون APT در in vivo سرکوب مستقیم آب (DS) و اثرات MTC بافت های نیمه جامد در اندازه گیری نقش دارند.الزامی است که این اثرات جدا و حذف شوند،که به طور کلی تلاش برای حذف آن ها با استفاده از آنالیز غیر متقارن طیف Z و با توجه به فرکانس آب صورت میگیرد. مجموع تمام تاثیرات سرکوب در یک آشفتگی مشخص آهنگ انتقال مگنتیزیشن نامیده می شود(MTR).
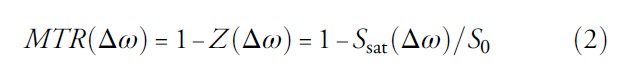
که ![]() شدت سیگنال در طیف Z است. اثر APT معمولا با استفاده از غیر یکنواختی MTR در آشفتگی محدوده ی +3/5 تا -3/5 ارزیابی می شود.
شدت سیگنال در طیف Z است. اثر APT معمولا با استفاده از غیر یکنواختی MTR در آشفتگی محدوده ی +3/5 تا -3/5 ارزیابی می شود.

که ![]() برای توضیح مولفه هایی غیر از APTR استفاده می شود، که به ویژه شامل exchange-related nuclear Overhauser effect (rNOE) پروتون های آلفاتیک، ماکرومولکول های متحرک در -3/5 ppm و غیریکنواختی ذاتی اثر MTC معمولی می شود. rNOE در محدوده ی بالای طیف Z و در انرژی پایین سرکوب، قابل مشاهده است و ناشی از واکنش مغناطیسی بین پروتون های آلفاتیک در پروتیین و پروتون های با قابلیت جابجایی آن می باشد که اثر سرکوب را به واسطه ی جایگزینی به سیگنال آب وابسته می کند. این عامل نباید با MTC نیمه جامد که در آن ناحیه وجود دارد و همچنین اثر NOE حاصل از پروتون های آلفاتیک، اشتباه گرفته شوند. اختلاف بین NOE های مستقیم و تقویت شده را می توان با بررسی میزان وابستگی سیگنال های NOE به pH افتراق داد. NOE های تقویت شده وابسته به pH بوده اما NOE های آزاد اینگونه نیستند.
برای توضیح مولفه هایی غیر از APTR استفاده می شود، که به ویژه شامل exchange-related nuclear Overhauser effect (rNOE) پروتون های آلفاتیک، ماکرومولکول های متحرک در -3/5 ppm و غیریکنواختی ذاتی اثر MTC معمولی می شود. rNOE در محدوده ی بالای طیف Z و در انرژی پایین سرکوب، قابل مشاهده است و ناشی از واکنش مغناطیسی بین پروتون های آلفاتیک در پروتیین و پروتون های با قابلیت جابجایی آن می باشد که اثر سرکوب را به واسطه ی جایگزینی به سیگنال آب وابسته می کند. این عامل نباید با MTC نیمه جامد که در آن ناحیه وجود دارد و همچنین اثر NOE حاصل از پروتون های آلفاتیک، اشتباه گرفته شوند. اختلاف بین NOE های مستقیم و تقویت شده را می توان با بررسی میزان وابستگی سیگنال های NOE به pH افتراق داد. NOE های تقویت شده وابسته به pH بوده اما NOE های آزاد اینگونه نیستند.
به دلیل این عوامل تاثیر گذار چندگانه تصاویر APT که به وسیله ی ![]() تعریف می شوند باید تصاویر با وزن APT نامیده شوند. به صورت نظری نشان داده شده است که هنگام استفاده از بیوپسی های مستقیم تحت راهنمایی تصاویر
تعریف می شوند باید تصاویر با وزن APT نامیده شوند. به صورت نظری نشان داده شده است که هنگام استفاده از بیوپسی های مستقیم تحت راهنمایی تصاویر ![]() ، این تصاویر که پایه ی سکانس های وزن APT در اسکنرهای 3T هستند برای تصویر برداری از تومورهای مغزی از اعتبار کافی برخوردارند. برای اندازه گیری بیشتر خالص APT و سیگنال های NOE در داخل بدن، چندین روش پردازش مختلفل پیش بینی شده است. بسیاری از این روش ها برای حذف بیشتر سیگنال های DS زمینه و MTC با استفاده از برخی اصلاحات طراحی شده اند. برای مثال اخیرا، Heo و همکارانش یک روش ریاضیاتی برای تخمین اثرات MTC و DS استفاده می نمودند که Extrapolated Semisolid Magnetization Transfer-Reference(EMR) نام گرفت. نتایج حاصل با دقت بالاتر APT، NOE، و نامیده می شوند که می توانند به وسیله ی افتراق طیف های Z جمع آوری شده از طیف های EMR محاسبه شده، به دست آیند.
، این تصاویر که پایه ی سکانس های وزن APT در اسکنرهای 3T هستند برای تصویر برداری از تومورهای مغزی از اعتبار کافی برخوردارند. برای اندازه گیری بیشتر خالص APT و سیگنال های NOE در داخل بدن، چندین روش پردازش مختلفل پیش بینی شده است. بسیاری از این روش ها برای حذف بیشتر سیگنال های DS زمینه و MTC با استفاده از برخی اصلاحات طراحی شده اند. برای مثال اخیرا، Heo و همکارانش یک روش ریاضیاتی برای تخمین اثرات MTC و DS استفاده می نمودند که Extrapolated Semisolid Magnetization Transfer-Reference(EMR) نام گرفت. نتایج حاصل با دقت بالاتر APT، NOE، و نامیده می شوند که می توانند به وسیله ی افتراق طیف های Z جمع آوری شده از طیف های EMR محاسبه شده، به دست آیند.
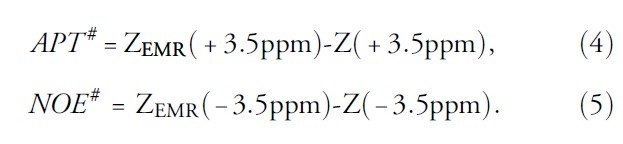
تصویربرداری APTw MRI کمی با روش EMR نشان داده است که در بیماران مبتلا به تومورهای مغزی یا استروک می تواند سیگنال های APT خاصی را ایجاد نماید. با اینحال بسته به روش اصلاح MTC زمینه، ممکن است سیگنال های هنوز شامل مقداری مولفه ی غیرمتوازنMTC علاوه بر مولفه های rNOE باشد. انتظار می رود تصویربرداری APTw کمی قابلیت چشمگیری برای بهبود دقت روش های تشخیصی داشته باشد اما این موضوع هنوز نیازمند اعتبار سنجی است.
APTw MRI Pulse Sequences
کاربرد بالینی APTw نیازمند تصویربرداری حجمی، مولتی اسلایس یا 3D سریع می باشد. از این بین تصویربرداری 3D ارجح است چرا که اختلافات افت های سرکوب ناشی از زمان آسایش T1 را در بین اسلایس ها به حداقل می رساند. چالش برانگیز ترین مشکلات تکنیکی هنگام طراحی سکانس های APTw محدودیت های سختی در دروه ی کار آمپلی فایر RF، طول پالس و آهنگ جذب ویژه (SAR) است. این موضوع به 3 روش نشان داده شده است:
- Pulse Train Presaturation (یک توالی از پالس های کوتاه که به وسیله ی فاصله ی زمانی از یکدیگر جدا شده اند): در برخی مطالعات پیش بالینی و در تحقیقات بالینی جدید از این روش استفاده شده است. Zhu و همکارانش یک فناوری 3D APTw را توسعه دادند که امکان جمع آوری اطلاعات در دستگاه های 3T بالینی را با استفاده از 4 عنصر 200 میلی ثانیه ای که با فاصله ی زمانی 10 میلی ثلنیه از یکدیگر جدا شده اند، را برای تصویربرداری GRASE با پالس های سرکوب چربی آدیاباتیک فراهم کرده است. مقدار SAR ترکیبی در این تکنیک 1/2 w/kg می باشد که ترکیبی از حدود 0/8 w/kg حاصل از RF سرکوب و باقی حاصل اشباع چربی و پالس های متمرکز کننده ی چندگانه می باشد. این سکانس به شکل موفقیت آمیزی برای مطلالعات بالینی در بسیاری از مراکز به کار گرفته شده است (شکل 2).
- Pulse Steady-State: در این سکانس اثر CEST به واسطه ی چند پالس پالس سرکوب تجمع یافته و هر یک از پالس های سرکوب کوتاه به وسیله ی یک خوانش دنبال می شود.
- Parallel RF Transmission (pTX)
در حال حاضر هیچ پالس سکانس مورد توافقی برای تصویربرداری APTw در سیستم های MRI بالینی به وسیله ی هیچ یک از تولید کنندگان معرفی نشده است. زمانی که یک منبع RF سرکوب (B1) به قدرت 2µT مورد استفاده قرار میگیرد سیگنال APT برای بافت نرمال مغز صفر بوده که ناشی از وجود (3/5 ppm) منفی می باشد. علاوه براین همواره سیگنال APTw در CSF باید نادیده گرفته شود. بنابراین با استفاده از این منبع و زمان سرکوب موثر (0/8 تا 2 ثانیه) تصاویر APTw در بیشتر نواحی نرمال مغزی شامل بطن ها، یکنواخت بوده و امکان تشخیص سیگنال های با شدت بالای APTw را در تومورهای با گرید بالا یا سیگناله های با شدت پایین را در بافت ایسکمی فراهم می کند. جدیدا یک روش جمع آوری اطلاعات معمولی با زمان اسکنی نسبتا بلند (5 تا 10 دقیقه) معرفی شده است که این زمان اسکن طولانی در آن ناشی از استفاده از فرکانس های مختلف RF سرکوب و چندین جمع آوری اطلاعات به منظور افزایش SNR می باشد. جدیدا چندین روش به منظور سرعت بخشیدن به جمع آوری اطلاعات سیگنال CEST/APT توسعه یافته است. این روش ها را می توان درگروه های: تکنیک های سریع معمولی (مانند GRASE و TSE) و تکنیک های کاهش حجم جمع آوری اطلاعات k-space (شامل keyhole، اسپکتروسکوپی با مدلسازی جبری، compressed sensing، snap shot CEST) که نیازمند پردازشگر پیشرفته ی اطلاعات هستند، جای می گیرند. امروزه انتظار ترکیب تکنیک compressed sensing با time-interleaved pTX برای ایجاد یک روش قوی تصویربرداری APTw در بالین وجود دارد.
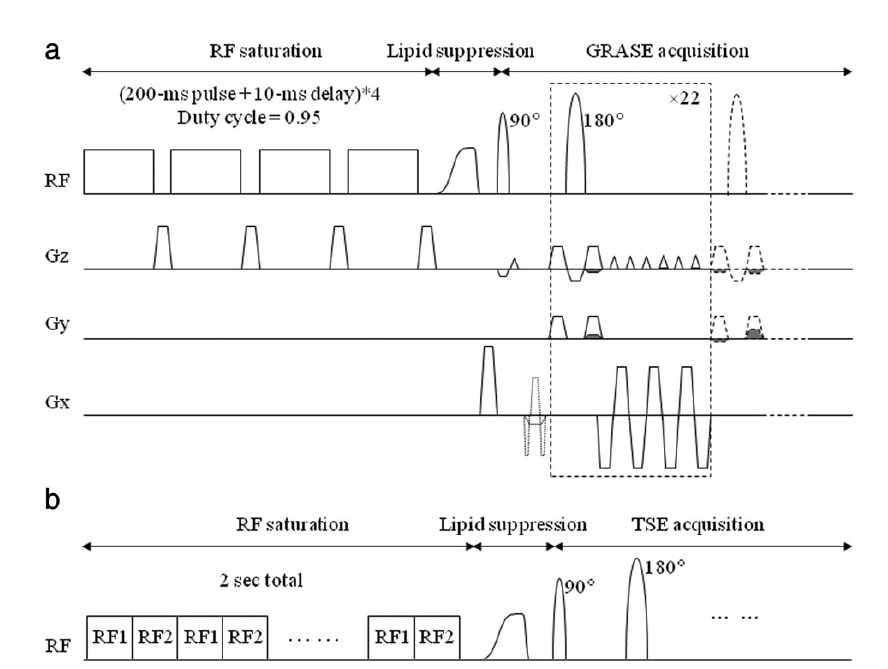
شکل 2
APTw MRI Acquisition Protocols
برای شناسایی اثر APT اغلب یک طیف Z کامل جمع آوری شده و سپس آنالیز غیریکنواخت صورت می گیرد. همانطور که مشاهده شد سیگنال APT در اطراف فرکانس 3/5 ppm در حداکثر مقدار خود قرار داشته و اغلب نیازمند جمع آوری چند تصویر محدود اشباع در فرکانس های -3/5 و +3/5 باید جمع آوری شود. با اینحال آنالیز غیریکنواخت MTR به واسطه ی غیریکنواختی میدان B0 دشوار می شود که سبب ایجاد اختلافات فرکانس بین وکسل ها می گردد. بنابراین شیمینگ خطی و لایه ی دوم برای تصویربرداری APT بسیار کمک کننده است. به منظور تصحیح عدم یکنواختی باقیمانده ی B0 در یک روش وکسل به وکسل، ضروری است که چندین آشفتگی را در اطراف فرکانس های -3/5 و +3/5 و همچنین نقشه ی منبع فرکانس آب را جمع آوری نمود (شکل 3). از آنجایی که اثر APT در داخل بدن کم است (2 تا 3 درصد از شدت اثر آب در تومورها) اغلب چند جمع آوری اطلاعات برای هر یک از آشفتگی ها، به منظور افزایش SNR حداقل تا 50:1 مورد نیاز است.یک مطالعه جدید نشان داده است که استفاده از 3 آشفتگی در اطراف فرکانس 3/5 و -3/5 و چندین جمع آوری اطلاعات مورد نیاز است تا تا تصاویر APTw با اصلاح مناسب غیریکنواختی B0 و SNR تهیه گردد.
نقشه برداری فرکانس آب را می توان با استفاده از روش منشا گیری جابجایی سرکوب چربی (WASSR) ایجاد نمود که آرایه ی طیفی فرکانسی با مقیاسی کمتر از هرتز فراهم می کند. در این روش از سکانسی مانند APTw استفاده میگردد، ااما به گونه ای که دارای مقدار B1 پایین و دوره ی سرکوب کوتاه (برای مثال 0/5µT و 100 میلی ثانیه) باشد و دامنه طیف Z را با سرکوب مستقیم فراهم کند. از آنجا که شکل این خط سرکوب Lorentzian است، فرکانس مرکزی آب را هم می توان با استفاده از آنالیز متقارن و هم اصلاح Lorentzian تعیین نمود. WASSR را می توان به دلیل جایگذاری کمتر انرژی با سرعت بیشتری انجام داد. اصلاحات غیریکنواختی میدان همچنین می تواند، در تصویربرداری CEST، با استفاده از روش گرادیان-اکو صورت گیرد. Keupp و همکارانش نیز یک روش به نام CEST-Dixon را توسعه دادند که یک ارزیابی ذاتی از غیریکنواختی میدان B0 را هنگام جمع آوری اطلاعات APT فراهم می کند. به صورت ذاتی روش های مرجع APT نسبت به روش های نقشه برداری جداگانه B0، به دلیل اطلاعات یکنواختی ایجاد و منعکس شده از میدان مغناطیسی، در طول جمع آوری اطلاعات حقیقی APTw محکمتر هستند. توجه داشته باشید که جمع آوری اطلاعات طیف Z در مقادیر پایین B1 یک فرکانس مرجع B0 را از طریق سیگنال آب فراهم می کند. در میدان های بالاتر، غیر یکنواختی میدان B1 ممکن است مشکلات بیشتری را ایجاد نماید.
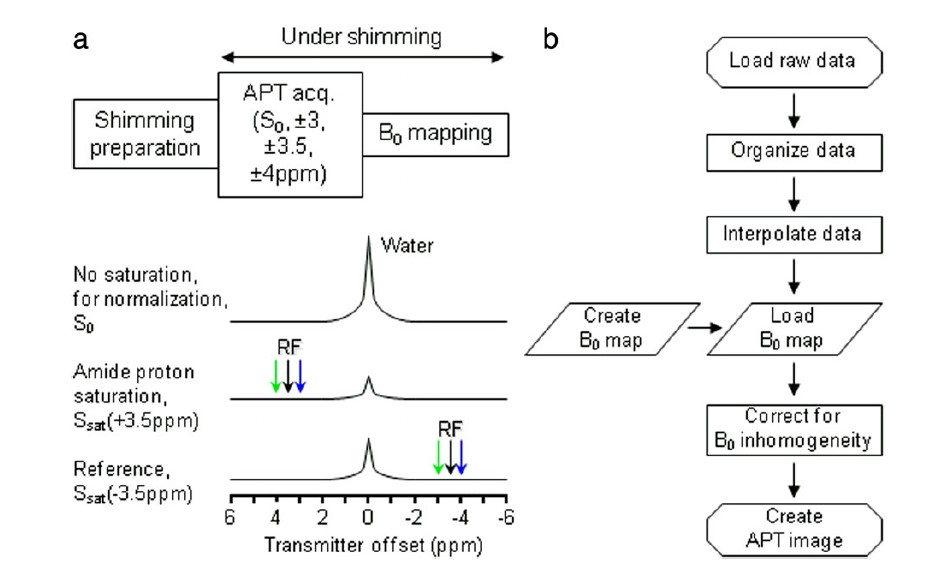
شکل 3
Challenging Issues And Controversies
چندین موضوع چالش برانگیز بر سر راه تصویربرداری بالینی APTw-based وجود دارد که برخی از آن ها مانند مشکلات توصیربرداری MTC هستند. این مسایل شامل محدودیت های آمپلی فایر RF اسکنر، ملاحظات SAR، زمان اسکن طولانی، وابستگی تفسیر تفسیر به پارامترهای مورد استفاده در اسکن و پتانسیل ایجاد آرتیفکت های غیریکنواختی میدان B0 و آرتیفکت های چربی می باشند.
Scanner Hardware
به طور معمول، در سیستم های حیوانی برای تصویربرداری APTw به منظور افزایش اثر APTw یک پالس RF سرکوب با استفاده از یک پالس CW black در چند ثانیه، به کار برده می شود. با اینحال سیستم های بالینی MRI به طور معمول، به ویژه هنگام استفاده از کویل های بزرگ مانند کویا تنه، محدود به دوره ی فعالیت آمپلی فایر و طول پالس سرکوب می باشند.به دلیل کمبود در ساتانداردهای مورد توافق بین محققین و تولیدکنندگان، پروتکل های تصویربرداری APTw و دیگر تکنیک های CEST به طور کلی در حال توسعه بوده و در بین مراکز مختلف بسیار متفاوت و بدون بهینه سازی هستند و مقایسه ی نتایج به دست آمده بسیار دشوار است. اخیرا مقدار قدرت پیشنهادی RF برای تصویربرداری APTw در تومورهای مغزی حدود 2µT و زمان کلی آن 0/8 تا 2 ثانیه (با امکان ایجاد تاخیر در بین پالس ها) برای ایجاد سیگنال زمینه ی یکنواخت در بافت مغزی نرمال، می باشد. غیر از این مورد، ممکن است کنتراست مناسب برای تصویربرداری APTw حاصل نشده و نتایج با اندازه گیری های منتشر شده بسیار متفاوت باشند.
APTw MRI Signal Contributions
بسیاری از مطالعات برروی مدل های انسانی و حیوانی به وضوح نشان داده اند که سیگنال های APT در هسته های تومورهای مغزی بیشتر از ادم اطراف تومور و بافت نرمال است. به صورت نظری تصویربرداری APTw پپتیدها و پروتیین های متحرک در بافت ( مانند پروتیین های سایتوسولیک، بسیاری از پروتیین های شبکه ی آندوپلاسمی و پروتیین های ترشحی) را آشکار می سازد، در حالیکه تصویربرداری MTC این کار را بر روی ماکرومولکول های نیمه جامد انجام می دهد. با توجه به پروتیین ها و پپتیدهای متحرک قله ی ترکیبی CEST در پهنای محدوده ی 3/5 ppm مربوط به پروتون های آمید backbone می باشد (شکل 4). علاوه براین پروتون های گوانیدیوم شاخه های فرعی گروه آرژنین و همچنین کراتین مربوط به قله های محدوده ی 2 ppm در تصاویر CEST می باشد. دانستن این موضوع بسیارمهم است که تصویربرداری CEST تنها پروتون های متحرک مشخصی را در پروتیین های باز هم مشخص، آشکار می کند که این موضوع وابسته به میزان دسترسی و تحرک آب است. بنابراین اندازه گیری های غلظت کلی پروتیین سلولی بیان کننده ی آنچه که در تصویربرداری APT آشکار می شود نبوده و نباید برای تفسیر نتایج این مهم از آن استفاده نمود.
اندازه گیری استاندارد ![]() براساس ترکیب چند عامل موثر در طیف Z آب می باشد که هر اثر یک به اندازه ی پارامترهای تجربی اشباع (مدت و قدرت B1، شکل پالس های RF و فاصله ی بین پالس ها) است. در مغز محدوده ی پایین طیف Z (فرکانس بالا،∆ꙍ) شامل مولفه های تمام پروتون های قابل تعویض، DS و اجزای بافت نیمه جامد است، در حالی که محدوده ی بالای طیفZ (فرکانس پایین،-∆ꙍ) علاوه بر DS دارای سیگنال های پروتیین ها و پپتید های متحرک (rNOE)، سیگنال های بر پایه ی NOE و نیمه جامد (MTC) میباشد. مولفه های نسبی این اثرات، تابعی از پارامترهای سکانس و قدرت میدان مغناطیسی B0 می باشد. هنگامی که از آنالیز غیرمتقارن استفاده می شود، این اثرات با یکدیگر ترکیب می شوند. در شرایط in vivo و قدرت میدان پایین (0/6 µT) مجموع تمام اثرات اشباع در محدوده ی بالا (rNOE+DS+MTC) برای بافت نرمال مغز و در فرکانس 3/5 ppm بسیار بزرگتر از مجموع تمام اثرات در محدوده ی پایین (APT+DS+MTC) می باشد، در حالیکه در تومور این اثرات تقریبا قابل مقایسه هستند. محتمل ترین تفسیر این است که سیگنال MTC نیمه جامد نامتقارن ناشی از شاخه های حذف شده در تومور به دلیل جایگزینی بافت سفید مغز با سلول های تومور می باشد. در قدرت های نسبتا بالا (2/1 µT) در شرایط in vivo نتایج تقریبا بالعکس هستند، به گونه ای که اثر سرکوب محدوده ی بالا در بافت نرمال مغزی در 3/5 ppm تقریبا معادل اثر سرکوب محدوده ی بوده و مقدار آن ها در تومورها بسیار متفاوت از یکدیگرند. بنابراین می توانیم نتیجه بگیریم که
براساس ترکیب چند عامل موثر در طیف Z آب می باشد که هر اثر یک به اندازه ی پارامترهای تجربی اشباع (مدت و قدرت B1، شکل پالس های RF و فاصله ی بین پالس ها) است. در مغز محدوده ی پایین طیف Z (فرکانس بالا،∆ꙍ) شامل مولفه های تمام پروتون های قابل تعویض، DS و اجزای بافت نیمه جامد است، در حالی که محدوده ی بالای طیفZ (فرکانس پایین،-∆ꙍ) علاوه بر DS دارای سیگنال های پروتیین ها و پپتید های متحرک (rNOE)، سیگنال های بر پایه ی NOE و نیمه جامد (MTC) میباشد. مولفه های نسبی این اثرات، تابعی از پارامترهای سکانس و قدرت میدان مغناطیسی B0 می باشد. هنگامی که از آنالیز غیرمتقارن استفاده می شود، این اثرات با یکدیگر ترکیب می شوند. در شرایط in vivo و قدرت میدان پایین (0/6 µT) مجموع تمام اثرات اشباع در محدوده ی بالا (rNOE+DS+MTC) برای بافت نرمال مغز و در فرکانس 3/5 ppm بسیار بزرگتر از مجموع تمام اثرات در محدوده ی پایین (APT+DS+MTC) می باشد، در حالیکه در تومور این اثرات تقریبا قابل مقایسه هستند. محتمل ترین تفسیر این است که سیگنال MTC نیمه جامد نامتقارن ناشی از شاخه های حذف شده در تومور به دلیل جایگزینی بافت سفید مغز با سلول های تومور می باشد. در قدرت های نسبتا بالا (2/1 µT) در شرایط in vivo نتایج تقریبا بالعکس هستند، به گونه ای که اثر سرکوب محدوده ی بالا در بافت نرمال مغزی در 3/5 ppm تقریبا معادل اثر سرکوب محدوده ی بوده و مقدار آن ها در تومورها بسیار متفاوت از یکدیگرند. بنابراین می توانیم نتیجه بگیریم که ![]() در میدان های B1 پایین دارای نقش بیشتری از غیرمتقارنی MTC بافت دارد، درحالیکه قدرت بالا به وسیله ی اثر APT مغلوب می گردد.
در میدان های B1 پایین دارای نقش بیشتری از غیرمتقارنی MTC بافت دارد، درحالیکه قدرت بالا به وسیله ی اثر APT مغلوب می گردد.
این اختلافات در مولفه های کنتراست APTw به عنوان تابعی از شرایط آزمون، هنگام مقایسه ی نتایج بین آزمایشگاه ها که از پارامترها و سکانس های و گاهی آنالیزهای مختلف استفاده می کنند سبب بروز چندین مباحثه شده است. بنابراین بسیار مهم است که روش های مورد استفاده را با دقت مورد بحث قرار داده و مستند گرداند. براساس یک اندازه گیری جدید از تومورها ما استفاده از APTw در میدان B1 پر محدوده ی 2µT و زمان سرکوب 0/8 s را توصیه میکنیم.
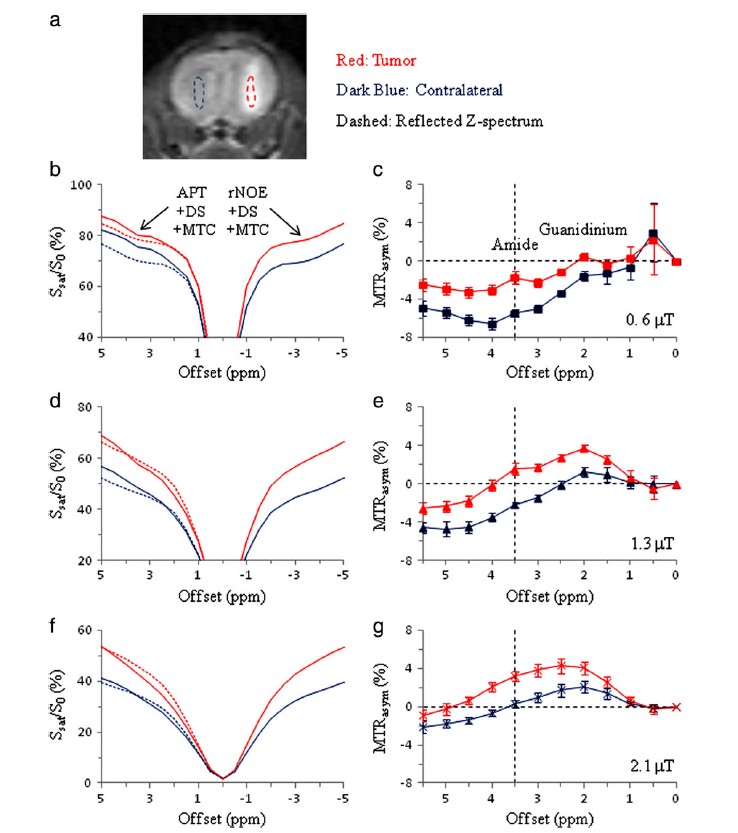
شکل 4
Quantification Methods Other Than
علاوه بر ![]() ،
، ![]() نیز که یک روش استاندارد سازی با استفاده از اسکن مرجع است و از(3/5 ppm) S(sat) به جای S0 که سبب مقادیر بالای اثر می کند، استفاده می گردد. بیشتر این روش ها از فرمول های Bloch-McConnell و مجموعی از اشکال Lorentzian به منظور متناسب سازی سیگنال های DS و MTC و مطالعه ی سیگنال های باقیمانده برپایه ی CEST شامل مولفه های APT و rNOE استفاده می کند. یکی از این روش های آنالیز اطلاعات آنالیز EMR (فرمول های 4 و 5) سعی می کند تا مولفه های DS و MTC زمینه را براساس برونیابی سیگنال های طیف Z حاصل از محدوده ی طیف پروتون در فاز مایع تخمین بزند. این روش ها اختصاصی تر به نظر می رسند. برای مثال برای مطالعه ی ایسکمی به منظور اجتناب از حذف جزیی دو سیگنال وابسته به pH (APT و rNOE) مناسب تر هستند. در خارج از مغز روش
نیز که یک روش استاندارد سازی با استفاده از اسکن مرجع است و از(3/5 ppm) S(sat) به جای S0 که سبب مقادیر بالای اثر می کند، استفاده می گردد. بیشتر این روش ها از فرمول های Bloch-McConnell و مجموعی از اشکال Lorentzian به منظور متناسب سازی سیگنال های DS و MTC و مطالعه ی سیگنال های باقیمانده برپایه ی CEST شامل مولفه های APT و rNOE استفاده می کند. یکی از این روش های آنالیز اطلاعات آنالیز EMR (فرمول های 4 و 5) سعی می کند تا مولفه های DS و MTC زمینه را براساس برونیابی سیگنال های طیف Z حاصل از محدوده ی طیف پروتون در فاز مایع تخمین بزند. این روش ها اختصاصی تر به نظر می رسند. برای مثال برای مطالعه ی ایسکمی به منظور اجتناب از حذف جزیی دو سیگنال وابسته به pH (APT و rNOE) مناسب تر هستند. در خارج از مغز روش ![]() با مشکل آرتیفکت های چربی سیگنال چربی در محدوده ی بالا، -3/5 ppm ، روبه رو است.
با مشکل آرتیفکت های چربی سیگنال چربی در محدوده ی بالا، -3/5 ppm ، روبه رو است.
فرمول اصلی آنالیزی APTR (فرمول 1) با تخمین پالس سرکوب ضعیف بیان می کند که APTR به صورت خطی وابسته به T1 است. این موضوع نگرانی درباره ی اینکه آیا نیازی به نرمال سازی T1 وجود دارد را افزایش می دهد. یک مطالعه ی پیش بالینی در سیستم 4/7 T نشان داد که اگرچه در تومور محتوای آب و T1 هر دو افزایش می یابند اما نسبت T1 به پروتون آب تقریبا بدون تغییر باقی می ماند. این موضوع بدان معناست که اثر افزایش T1 بر سیگنال های اندازه گیری شده ی APT همانگونه که در مطالعات اولیه ی APTw مشاهده شد، اکثرا به وسیله ی محتوای پروتون های آب درون تومور خنثی می شود. علاوه بر این دو مطالعه ی جدید دیگر نیز به وضوح نشان دادند که در محدوده ی پایین B1 (<1 µT) سیگنال ![]() با T1 افزایش یافته و در محدوده ی میانی B1 (1/5-2/5 µT) غیر حساس بوده و در محدوده ی بالای B1 (>3 µT) نسبت به T1 کاهش می یابد. این محققین نتیجه گرفتند که ممکن است الزامی برای از بین بردن اثر T1 در این تصاویر وجود نداشته باشد. اخیرا دو اندازه گیری متفاوت برای CEST تعریف شده اند:
با T1 افزایش یافته و در محدوده ی میانی B1 (1/5-2/5 µT) غیر حساس بوده و در محدوده ی بالای B1 (>3 µT) نسبت به T1 کاهش می یابد. این محققین نتیجه گرفتند که ممکن است الزامی برای از بین بردن اثر T1 در این تصاویر وجود نداشته باشد. اخیرا دو اندازه گیری متفاوت برای CEST تعریف شده اند: ![]() (تفریق معکوس طیف Z برای اصلاح اثرات( DS و MTC) و AREX (استفاده از ضریب وابستگی جایگزینی برای حذف اثز مولفه ی T1) (فرمول های 7 و 8). دو مطالعه ی جدید نشان داده اند که استفاده از AREX سبب کاهش کنتراست تومور میگردد، با اینحال این کنتراست می توانست در برخی موارد منحصر به فرد بوده و استفاده های اختصاصی داشته باشد.
(تفریق معکوس طیف Z برای اصلاح اثرات( DS و MTC) و AREX (استفاده از ضریب وابستگی جایگزینی برای حذف اثز مولفه ی T1) (فرمول های 7 و 8). دو مطالعه ی جدید نشان داده اند که استفاده از AREX سبب کاهش کنتراست تومور میگردد، با اینحال این کنتراست می توانست در برخی موارد منحصر به فرد بوده و استفاده های اختصاصی داشته باشد.
Confounding APTw MRI Signal Contributions Artifactual And Real
به مانند سکانس های دیگر MRI، APTw نیز دارای برخی مولفه های پیچیده کننده ی سیگنال است که می توانند تفسیر را دشوار یا دچار اشتباه گردانند. این موارد ممکن است دارای منشا تکنیکی یا اجزای بافت تحت بررسی باشد. از نظر تکنیکی یکنواختی میدانB1 همچنان یک موضوع مهم در تصویربرداری APT است. این سکانس به دلیل ویژگی های فیزیکی وابسته به یکنواختی B0 در محدوده ی مورد نظر تصویربرداری است چرا که این موضوع موقعیت رزونانس آب را به شدت تحت تاثیر قرار می دهد.
نواحی نکروزی Liquefactive بزرگ، خونریزی ها و یا رگ های بزرگ به صورت معمول سیگنال های بالا APTw را نشان می دهند. توجه به تفاوت سیگنال APT در نکروز Liquefactive با نکروز Coagulative در نواحی مرکزی گلیوماهای مرکزی، همانگونه که در تصاویر T2 و Flair شناسایی می شوند دارای اهمیت هستند. به دلیل ویژگی های نکروز Liquefactive پپتیدها و پروتیین های موجود در آن تمایل بیشتری به حرکت در محیط نکروز دارند و در نتیجه افزایش غلظت پپتیدها و پروتیین های متحرک سبب افزایش سیگنال بافت در تصاویر APTw می گردد. از سوی دیگر نکروز Coagulative به شدت حرکت پروتیین ها را محدود می کند و به تبع آن سبب کاهش سیگنال آن ها در تصاویر APTw می شود. علاوه براین شریان های داخل تومور در گلیوماهای با گرید پایین همواره سیگنال APT بالایی را در تصاویر از خود نشان می دهند که بسیار شبیه به تومورهای بدخیم است. این موضوع در کبد نیز بسیار رخ می دهد چرا که سیستم پورتال داخلی مبد و شریان های کبدی همواره در تصاویر APTw به صورت hyperintense مشاهده می شوند. خوشبختانه نواحی نکروز Liquefactive و خونریزی اغلب در تصاویر ساختاری MRI قابل مشاهده هستند و بنابراین هنگام بررسی تصاویر APTw همواره باید جهت تشخیص شناسایی آرتیفکت ها با سیگنال بالا باید به تصاویر ساختاری MRI مراجعه نمود. علاوه براین رگزایی موجود در تومورهای بدخیم در تصاویر APTw اغلب به صورت hyperintense مشاهده می شوند که در این مورد نیز باید تصاویر ساختاری MRI بررسی گردند.





