MRI Contrast Agents
ویژگی مغناطیسی مواد به وسیله ی پذیرفتاری آن ها مشخص می شود که توضیحی برای توانایی مواد در مغناطیس شدن به واسطه ی قرار گیری در میدان مغناطیسی است.
مگنتیزیشن (M) بیانگر بردار مغناطیسی مطلق (Net Magnetic Momentom) در واحد حجم است که به صورت موازی با میدان مغناطیسی خارجی قرار گرفته است. مگنتیزیشن مواد به دلیل وجود الکترون ها (مغناطیس الکترونی) یا هسته ی اتم (مغناطیس هسته ای) است. مگنتیزیشن ایجاد شده توسط یک الکترون 657 برابر بیشتر از مگنتیزیشن ایجاد شده به وسیله ی پروتون است و مغناطیس حاصل از هسته را پوشش می دهد. براساس رفتاری که مواد در میدان مغناطیسی از خود بروز داده اند چند نوع ذره را می توان شناسایی نمود.
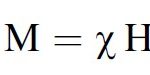
ذرات دیامغناطیس و پارامغناطیس
اکثر اتم های تشکیل دهنده ی بافت های بدن به دلیل نداشتن الکترون های جفت نشده دیامغناطیس هستند. با این حال یک میدان مغناطیسی خارجی ممکن است بتواند اندکی مسیرهای اوربیتالی الکترون ها را تغییر داده و مقدار کمی مگنتیزیشن را در خلاف جهت میدان خارجی ایجاد نماید. مواد دیامغناطیس به دلیل اثرشان برروی زمان آسایش T1 و T2 به عنوان مواد حاجب MRI مورد استفاده قرار نمیگیرند.
یون ها و مولکول هایی که دارای الکترون های جفت نشده هستند، تمایل دارند در جهت میدان مغناطیسی خارجی آرایش یافته و اثر آن را افزایش دهند. هرچه الکترون های جفت نشده ی ذره بیشتر باشد بردار مغناطیسی حاصل از آن بزرگتر خواهد بود. فلزات واسطه (، ، ، ، و ) و لانتانیدها ( و ) دارای تعداد بالایی الکترون جفت نشده هستند. یون گادولینیوم با 7 الکترون جفت نشده دارای برداری مغناطیسی بزرگی می باشد، این یون اولین انتخاب برای استفاده در مواد حاجب پارامغناطیس MRI است.
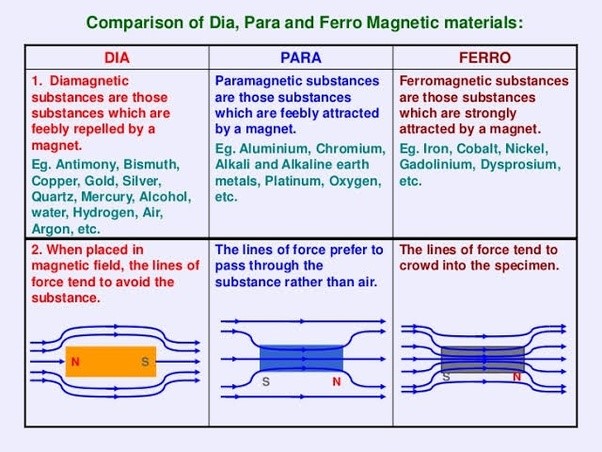
مواد فرومغناطیس
در حالی که مواد پارامغناطیس از یون های ایزوله تشکیل شده است، مواد فرومغناطیس از کنار هم قرار گرفتن هزاران اتم در یک ساختار پارامغناطیس کریستالی ایجاد می شود. درون ترکیبات فرومغناطیس قلمروها و مرزهایی وجود دارد که هر یک از قلمروها در کل یک بردار مگنتیزیشن را ایجاد می کنند. قبل از قرار گیری این مواد در میدان مغناطیسی خارجی برآیند مگنتیزیشن آن ها صفر است اما پس از آنکه در یک میدان مغناطیسی قرار میگیرند، مرزبندیها تغییر کرده و برآیند مگنتیزیشن آن ها در راستای میدان مغناطیسی خارجی خواهد بود. هنگامی که میدان مغناطیسی خارجی به مقدار معینی میرسد مگنتیزیشن این مواد نیز به حالت اشباع () در می آین و بیش از آن افزایش نمی یابد. هنگامی که میدان مغناطیسی خارجی حذف می شود مگنتیزیشن این مواد به کندی کاهش یافته و به مقدار ثابتی می رسد که این مقدار به دما و ویژگی های ماده بستگی دارد. نیروی Coercive (یا Coercivity) شدت میدان مغناطیسی مورد نیاز برای به صفر رساندن مگنتیزیشن این مواد، پس از قرار گیری در حالت اشباع را نشان می دهد.
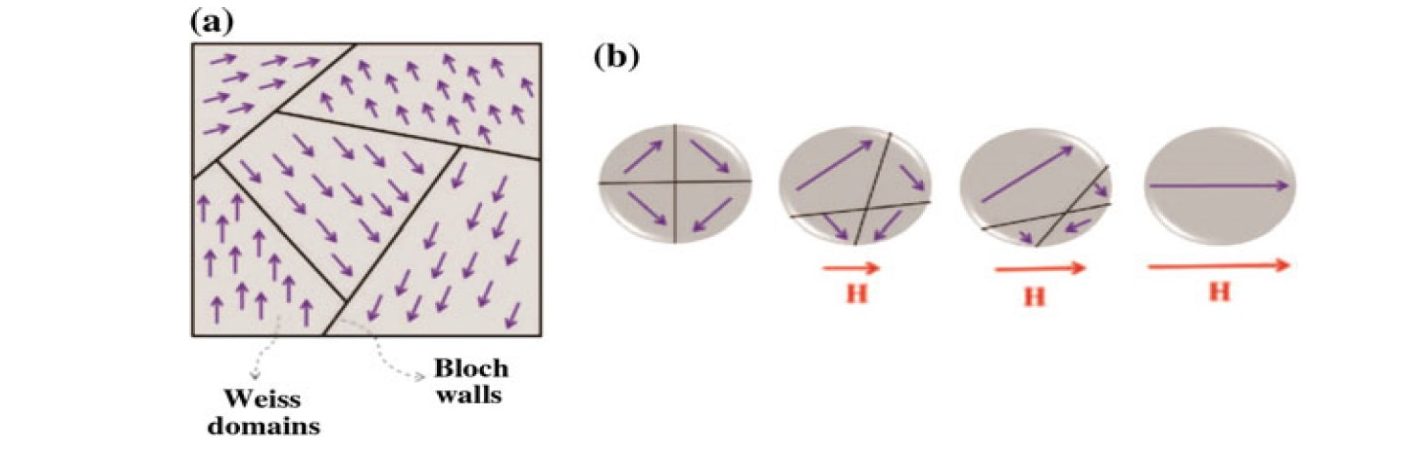
ذرات سوپرپارامغناطیس
مفهوم مواد سوپرپارامغناطیس بسیار نزدیک به مواد فرومغناطیس است و تفاوت آن ها در میزان انسجام قلمرو های مغناطیسی است. هنگامی که میدان مغناطیسی خارجی از اطراف این مواد حذف می شود نواحی مختلف مغناطیسی به صورت تصادفی آرایش یافته و برآیند آن ها صفر می شود. این مواد هنگامی ایجاد می شوند که اندازه ی کریستال به قدری کوچک باشد که در آن ها تنها یک قلمرو مغناطیسی وجود داشته باشد. سوسپانسیون نانوذرات اکسید آهن کوچکتر از 20 نانومتر در دمای اتاق رفتار سوپرپارامغناطیسی از خود بروز می دهند. درجه ی هماهنگی و ساماندهی بردارهای مغناطیسی وابسته به دما بوده و با آن رابطه ی عکس دارد.
دسته بندی مواد حاجب MRI
مواد حاجب MRI را می توان بر اساس ویژگی های زیر دسته بندی نمود:
- ویژگی های مغناطیسی
- ترکیبات شیمیایی
- وجود یا عدم وجود اتم های فلزی در ترکیبات آن ها
- روش استفاده
- تاثیر بر تصاویر MRI
- توزیع زیستی
- کاربردها
ویژگی های مغناطیسی
بیشتر مواد حاجب MRI یا ترکیبات با پایه ی گادولینیوم یا ذرات سوپرپارامغناطیس اکسید آهن هستند. مواد حاجب پارامغناطیس معمولا دارای یون های دیسپوزیوم، گادولینیوم و یا منگنز هستند که ویژگی های محلولیت پذیری در آب بالایی دارند. رایج ترین اتم مورد استفاده در مواد حاجب MRI یون گادولینیوم می باشد چرا که به صورت طبیعی دارای بیشترین تعداد الکترون جفت نشده و پایداری بالا می باشد. به دلیل وجود الکترون های جفت نشده در ساختار این یون ها، این مواد دارای ویژگی های پارامغناطیسی می باشند. مواد حاجب دارای Gd زمان آسایش T1 و T2 را کاهش می دهند. کاهش آسایش T1 در غلظت های پایین نیز اتفاق می افتد ولی کاهش زمان آسایش T2 هنگام استفاده از این مواد تنها در غلظت های بالا رخ می دهد به همین دلیل استفاده از Gd به منظور تصویربرداری T2 محدودیت بالینی می باشد. مواد حاجبی که دارای فلزات واسطه مانند منگنز یا اکسید آهن هستند اثر بیشتری بر تصاویر T2 دارند.
مواد حاجب پارامغناطیس
موادحاجب با پایه ی گادولینیوم: این مواد در سه دسته ی: مواد حاجب خارج سلولی (ECF)، مواد حاجب شناور در خون (BPCAS) و مواد حاجب ویژه بافت.
مواد حاجب با پایه ی منگنز: کلات های منگنز یا مواد حاجب با پایه ی منگنز سیگنال T1 را افزایش می دهند و و برای تشخیص ضایعات کبدی مورد استفاده قرار می گیرند. در بدن انسان کلات به دو قسمت منگنز و DPDP تقسیم می شود. منگنز توسط سلول های کبدی جذب می شود و به وسیله ی صفرا دفع می گردد اما قسمت DPDP به وسیله ی کلیه ها دفع می گردد. منگنز از طریق کانال های کلسیم غشا سلولی وارد آن می شوند، بنابراین از این گروه می توان در تصویر برداری عملکردی مغز استفاده نمود.
مواد حاجب سوپرپارامغناطیس
مواد حاجب اکسید آهن: دو نوع مواد حاجب اکسید آهن وجود دارد: اکسید آهن سوپرپارامغناطیس (SPIO) و اکسید آهن سوپرپارامغناطیس بسیار کوچک (USPIO). مواد حاجب سوپرپارامغناطیس محتوی کلویید نانوذرات معلق اکسید آهن می باشند. هنگامی که از این مواد برای تصویربرداری استفاده می کنیم، سیگنال T2 در بافت هایی که این مواد را جذب می کنند کاهش می یابد. مواد حاجب SPIO و USPIO خروجی های موفقیت آمیزی در تشخیص ضایعات کبدی نشان داده اند. اندازه ی نانومتری و شکل ذرات این مواد حاجب امکان استفاده از آن ها در موارد و کاربردهای مختلف فراهم می کند که در مواد حاجب دیگر دیده نمی شود.
مواد حاجب آهن- پلاتین: در مقایسه با نانوذرات اکسید آهن،ذرات سوپرپارامغناطیس آهن-پلاتین (SIPPS) به نظر می رسد که به شکل قابل توجهی ویژگی های آسایشی T2 را بهبود می دهند. این مواد توسط کپسولی از جنس فسفولیپید احاطه شده اند که به شکل ویژه توسط سولوهای سرطانی پروستات جذب می شوند. استفاده از این مواد هنوز در دست تحقیق است.
ساختار شیمیایی و وجود یا عدم وجود اتم فلزی در ساختار
به منظور کاهش سمیت یون های فلزی مفهوم کلات کردن معرفی شده است. اثرات حاد و مزمن این سمیت با کلات شدن این مواد به شدت کاهش می یابد.
همان گونه که پیش از این بیان شد گادولینیوم به شکل یون گادولینیوم (III) مورد استفاده قرار می گیرد. این یون بسیار ضعیف به پروتیین های سرم انسانی متصل می شود و ممکن است از آن ها جدا گردد. نمک های لانتانید ها در بدن هیدرولیز شده و تبدیل به هیدروکسیدها می شوند که توسط شبکه RES جذب شده و به ویژه در کبد، طحال و استخوان ها تجمع می یابند.
کلات سازی مواد حاجب با پایه ی Gd
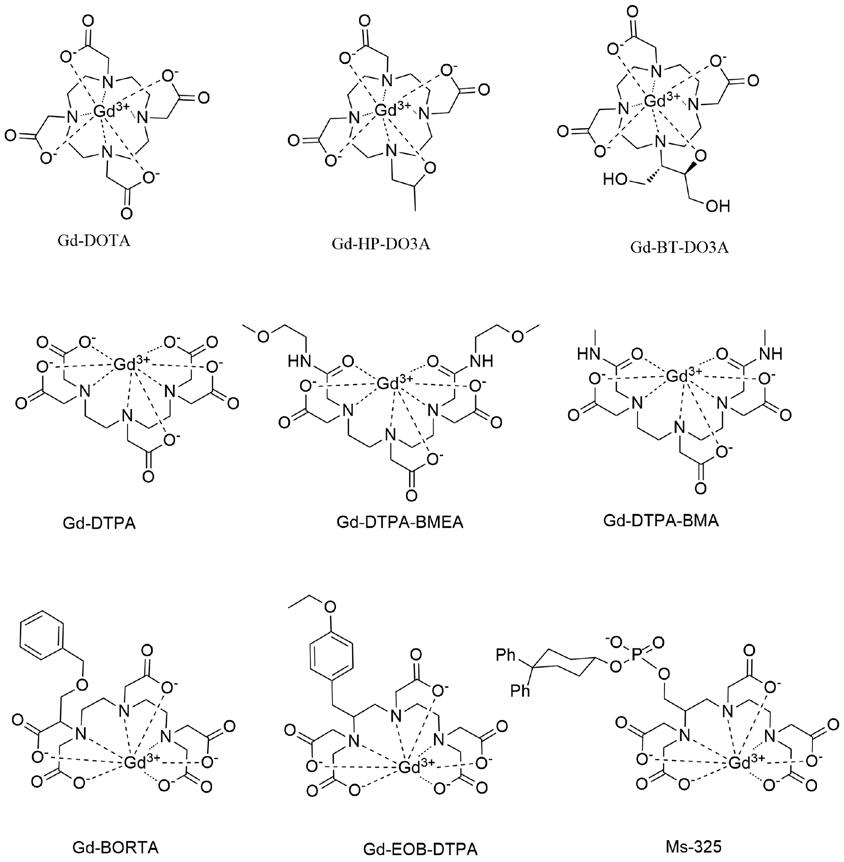
شکل زیر ترکیبات کلات مواد حاجب با پایه ی گادولینیوم را نشان می دهد که در فعالیت های بالینی مورد استفاده قرار می گیرند. در کل 3 نوع کلات در این مواد یافت می شود:
- ترکیبات یونی و آبدوست
- ترکیبات آبدوست غیریونی
- ترکیبات چربی دوست و یونی
روش استفاده
مواد حاجب داخل وریدی یونی:
اولین ماده حاجب داخل وریدی مورد استفاده از کلات های پارامغناطیس یون Gd و Cr در ترکیب با Ethylenediamin eteraacetic acid (EDTA) تشکیل شده بود. EDTA نسبتا ناپایدار بود و از خود اثراتی سمی برروی بدن حیوانات باقی می گذارد. Gd-DTPA به صورت موفقیت آمیزی مورد استفاده قرار گرفته است که این موضوع به دلیل پایداری بالای آن بود و این ماده اولین ماده ی حاجب داخل وریدی MRI بوده است که در بالین به کار گرفته شد. گادولینیوم دارای بردار مغناطیسی بزرگ است و حتی در غلظت های پایین دارای ویژگی پارامغناطیس بالا و سمیت پایین می باشد.پس از تزریق داخل وریدی، این ماده ابتدا داخل عروق و سپس در فضای بین سلولی پخش شده و سپس به سرعت از طریق ادرار دفع می شود.
مواد حاجب داخل وریدی غیر یونی
این مواد حاجب همگام با مواد حاجب یونی mri توسعه یافته است. هنگام استفاده از این مواد حاجب برخی اثرات جانبی که زمان مربوط به اسمولاریته مواد حاجباست کمتر رخ میدهد. Gadodiamid یک ترکیب غیریونی است که اسمولالیته ی آن تنها ۵/٢ اسمولالیته ی Gd-DTPA می باشد. با توجه به میانگین دز کشنده ی 34 mmol/kg گادو دی آمید دارای ایمنی ٣-٢ برابر Gd-DOTA و ۴-٣ برابر ایمنی Gd-DTPA می باشد. تزریق گادو دی آمید سبب إیجاد اختلال در سطح بیلی روبین خون نمی شود. با این حال تحقیقی که برروی ٧٣ نفر انجام شد نشان داد که افزایش آهن خون یک نگرانی بالقوه با شیوع ٢/٨ ٪ حتی در زمان استفاده از گادو دی آمید میده می شود. Gadoteridol سومین ماده حاجب داخل وریدی غیریونی است که به صورت تجاری عرضه می شودو اسمولالیته ی آن مانند گادو دی آمید می باشد.
مواد حاجب خوراکی (OCAS)
استفاده از این مواد برای تصویربردای mri از لوله و دستگاه گوارشی رایج است. آبمیوه های طبیعی تهیه شده مانند بلوبری و چای سبز به عنوان مواد حاجب خوراکی در mri سال ها مورد مطالعه قرار گرفته اند. مواد حاجب خوراکی مصنوعی بر پایه ی یون های فلزی سنگین مانند گادولینیوم، منگنز، مس و آهن می باشند. همچنین از هوا برای کاهش شدت سیگنال در تصاویر T2 مورد استفاده قرار میگیرد.
مواد با پایه ی Gd، SPIO، مواد حاوی منگنز و سوسپانسیون سولفات باریوم به عنوان مواد حاجب خوراکی مصنوعی مورد استفاده قرار میگیرند. یون دو ظرفیتی منگنز به شدت زمان آسایش T1 را کاهش می دهند. منگنز از طریق کانال های کلسیم، وارد سلول های تحریک پذیر مانند نورون ها و سلول های میوکارد می شود. بنابراین می توان از آن به عنوان یک نشانگر برای بررسی فعالیت کانال های کلسیمی استفاده نمود.
تاثیر بر روی تصویر
مواد حاجب پارامغناطیس به غیر از ترکیبات با پایه ی Dy مواد حاجب مثبت بوده و تاثیرات مشابهی بر روی آسایش T1 و T2 می گذراند. با اینحال از آنجایی که مقدار T1 بافت بیشتر از T2 آنها است، تاثیر غالب در غلظت های پایینرا در تصاویر T1 مشاهده می کنیم.
مواد حاجب منفی آسایش T2 را کاهش می دهند وسبب کاهش سیگنال بافت ها می شوند. مواد حاجب فرومغناطیس و سوپرپارامغناطیس در این دسته قرار می گیرند.
مواد حاجب T1: اثر اصلی آنها کاهش زمان آسایش T1 است و میزان این تغییر وابسته به آهنگ انتقال انرژی تهییج شده ی پروتون به مواد اطراف است.
موادحاجب T2: اثر اصلی آنها کاهش زمان آسایش T2 می باشد. اثر این مواد وابسته به میزان پروتون هایی است که با یکدیگر در فاز مخالف قرار دارند.
توزیع بالینی و کاربردها
مواد حاجب خارج سلولی (ECF): این مواد در فضای خارج سلول پخش می شوند و مدتی برای تصویربرداری از کبد از آن ها استفاده می شد اما امروزه رایج ترین مواد حاجب مورد استفاده در MRI هستند. این مواد داخل عروق گردش می کنند و آزادانه در فضای خارج سلولی توزیع می یابند و بیشتر از طریق کلیه دفع می شوند. Gd از طریق شریان هپاتیک و ورید پورت وارد کبد می شود. هر یون Gd بر چندین مولکول اطراف خود اثر گذاشته و آسایش آن ها را کاهش می دهد.
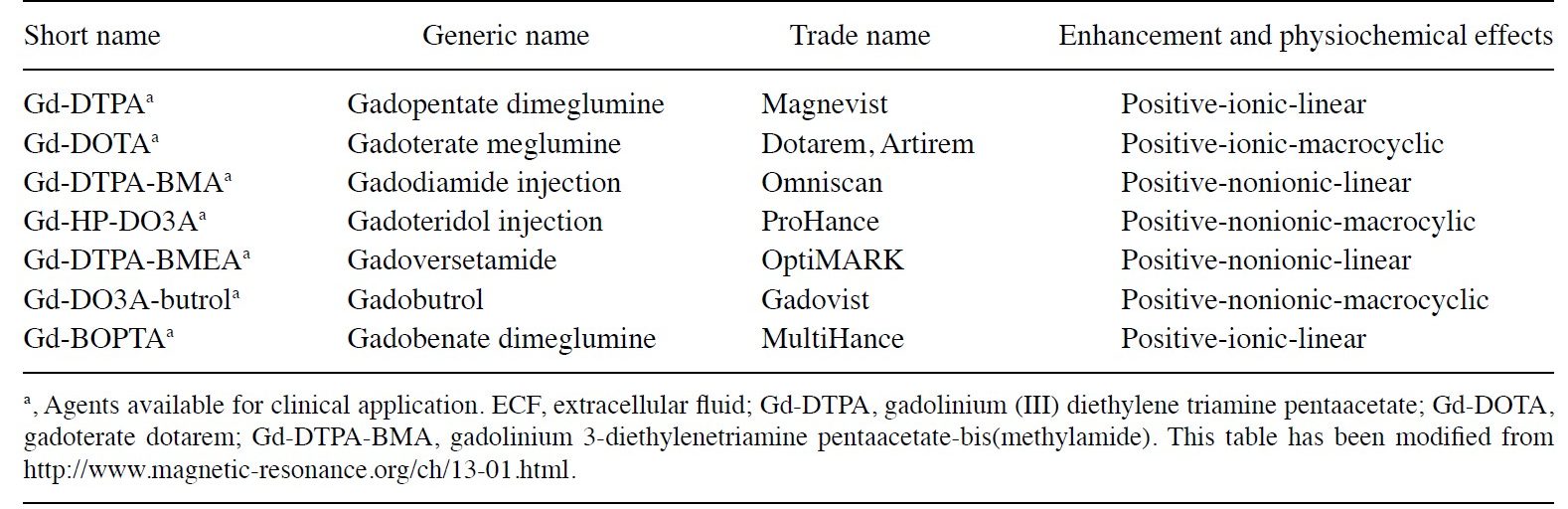
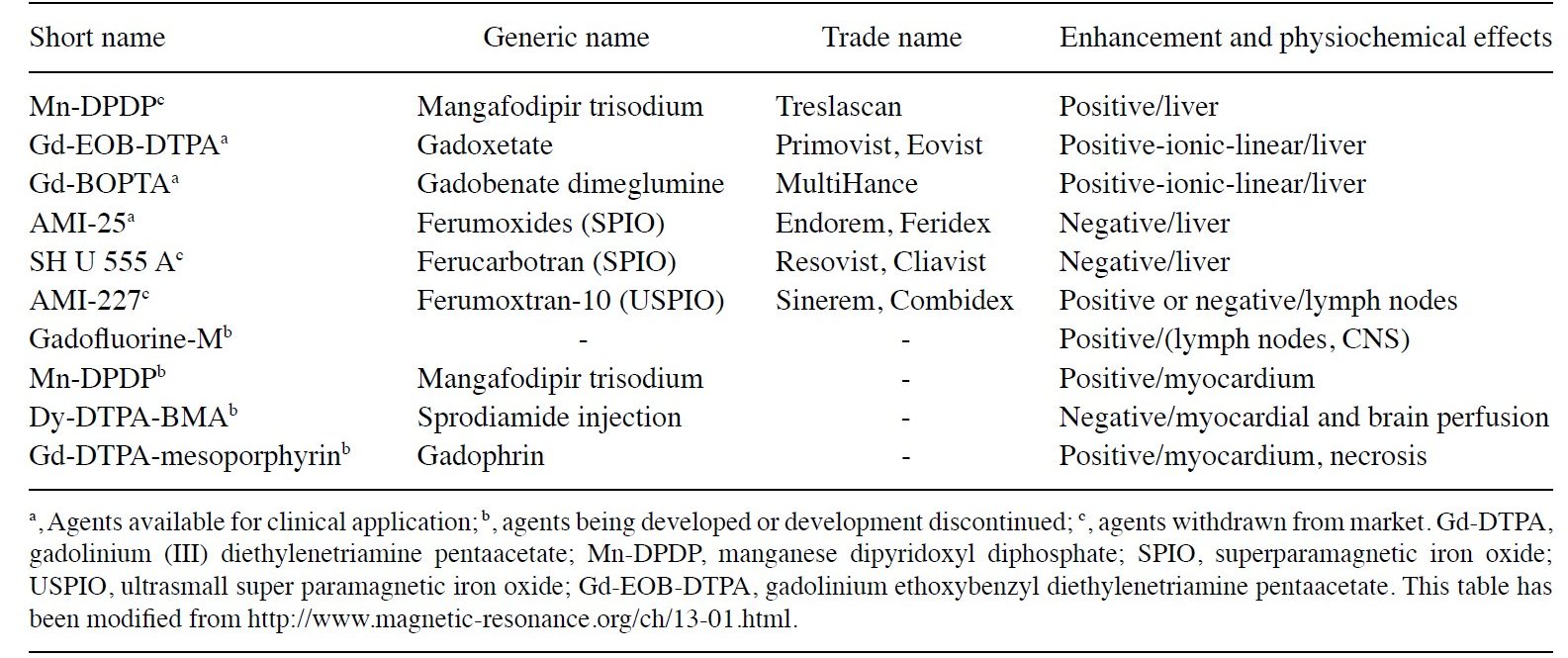
مواد حاجب شناور در خون (BPCAS): همچنین با عنوان مواد حاجب داخل عروقی شناخته می شوند. این مواد نسبت به مواد حاجب ECF مدت زمان بیشتری را درون عروق باق می مانند و زمان بیشتری را برای تصویربرداری از عروق فراهم می کنند. لیستی از این مواد در جدول زیر آورده شده است.
این مواد را می توان بر اساس عملکردشان در 3 دسته تقسیم بندی کرد:
- سیستم های با پایه ی باندینگ غیرکووالانسی low molecular Gd که به آلبومین سرم انسان (HSA) متصل می شوند تا از خروج سریع آن ها از عروق جلوگیری نمود .
- سیستم هایی که با همکاری پلیمرها یا لیپوزوم ها میزان نشت به فضای خارجی را به واسطه ی افزایش مولکولی آن ها کاهش می دهند.
- سیستم های با پایه ی نانوذرات، که در مسیر دفعشان تغییر ایجاد می شود.
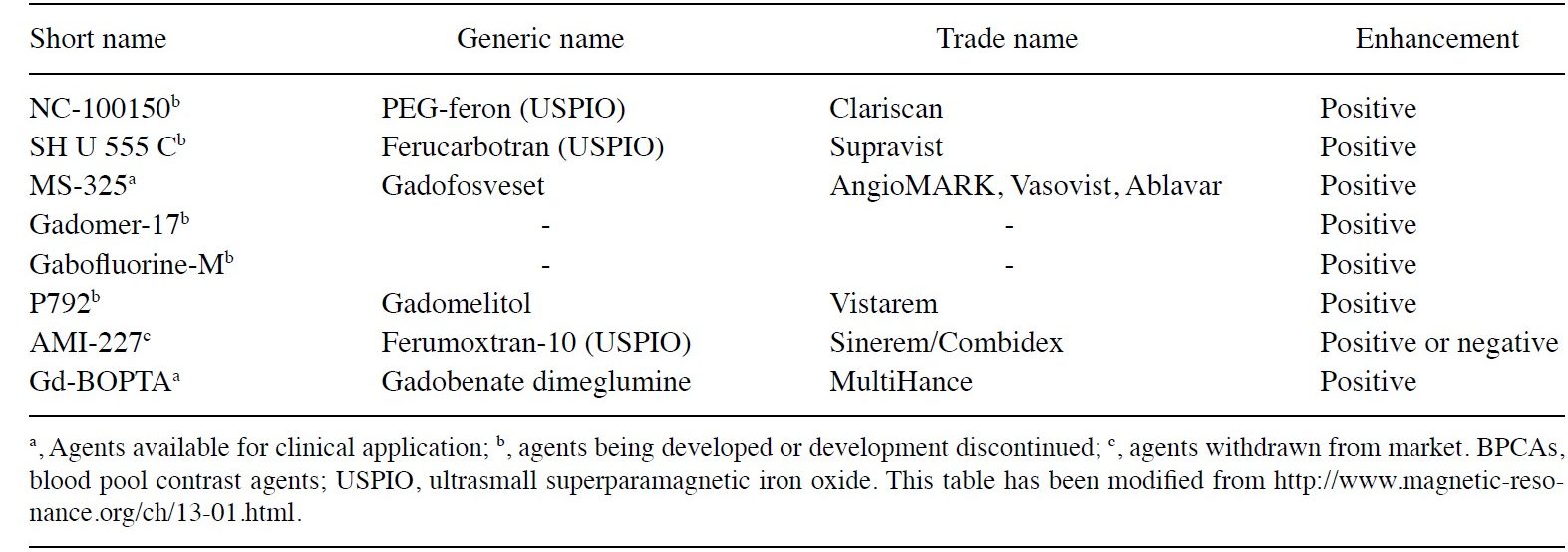
دسته ی سوم را می توان به 3 دسته گزارش داد:
- ذرات USPIO
- موادی که به صورت برگشن پذیر به پروتیین های پلاسما متصل می شوند
- ماکرومولکول ها و مواد حاجب هدفمند و ویژه ی ارگان ها (در جدول زیر تعدادی از این مواد آورده شده است.)
GBCAS
این مواد با افزایش R1 و R2 در اسپین های نزدیک سبب انهنسمنت می شوند. می توان با استفاده از R1 و R2 میزان کارایی این مواد را سنجید.
مقدار آسایش طولی و عرضی، R1 و R2، وابسته به غلظت مولار ماده حاجب می باشد که اغلب به صورت میلی مولار گادولینیوم بیان می شود. مواد حاجب T1 معمولا دارای نسبت R2/R1 بین 1 تا 2 می باشند، در حالیکه این مقدار برای مواد حاجب T2 مانند ذرات اکسید آهن 10 یا حتی بیشتر می باشد. منشا اثر پارامغناطیس معمولا به دو مکانیسم حلقه ی داخلی (IS) و حلقه ی خارجی (OS) تقسیم می شود.
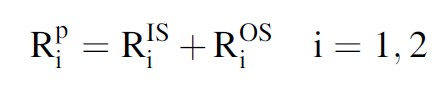
یون گادولینیوم به عنوان یون فلزی در مواد حاجب T1 مورد استفاده قرار می گیرد که به دلیل برداری مغناطیسی بزرگ و وضعیت الکترونی متقارن آن می باشد. یون های گادولینیوم در مقایسه با لانتانیدهای دیگر دارای آسایش الکترونی بلند ( تا ثانیه) می باشد که این موضوع امکان انتقال اثر مغناطیسی به مولکول های آب اطراف را فراهم می کند. آسایش R1 و R2 در این ترکیبات در محدوده ی 3-10 در میدان 5/1 تسلا می باشد اما به دلیل آنکه میزان T1 بافت بسیار بیشتر از T2 آن ها است اثر این مواد در مقدار T1 بسیار قابل توجه تر از T2 است. هرچه وزن T1 در تصویری بیشتر باشد میزان افزایش کنتراست به واسطه ی استفاده از این مواد حاجب بیشتر خواهد بود.
به دلیل نزدیک بودن شعاع یون گادولینیوم به یون کلسیم، این یون می تواند در بافت ها جایگزین آن ها شود. علاوه براین یون های Gd در pH فیزیولوژیک غیرپایدار بوده و سبب تولید کریستال های هیدروکسید گادولینیوم می شود ممکن است در عروق رسوب نموده و آن ها را مسدود نماید، برای رفع این خطر این یون را به صورت کامل لیگاند می کنند.
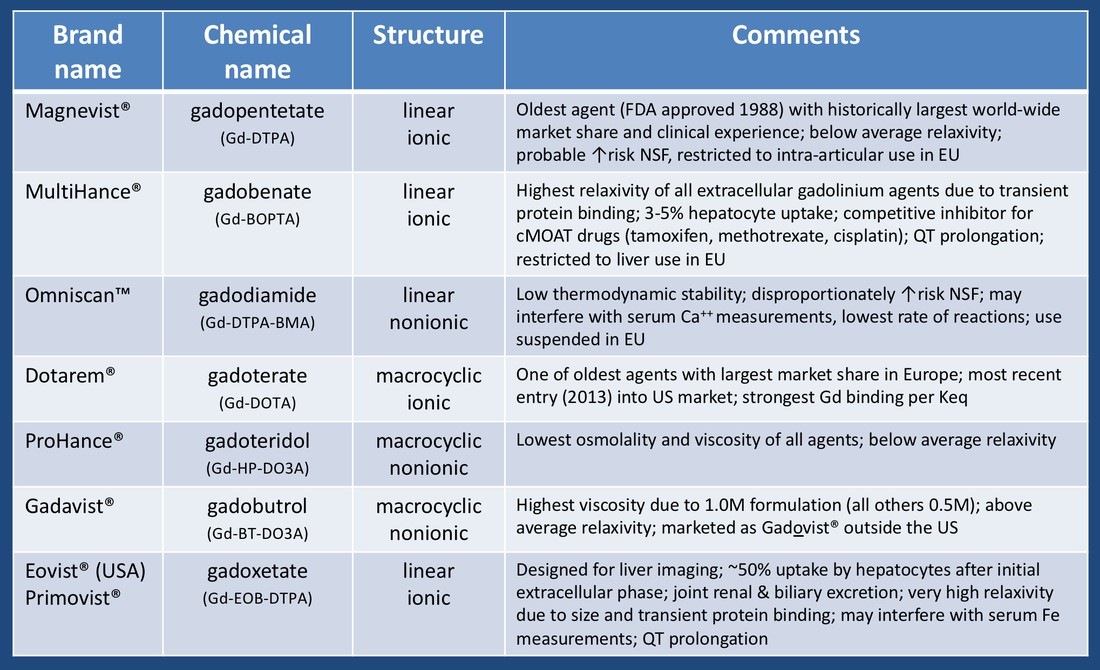
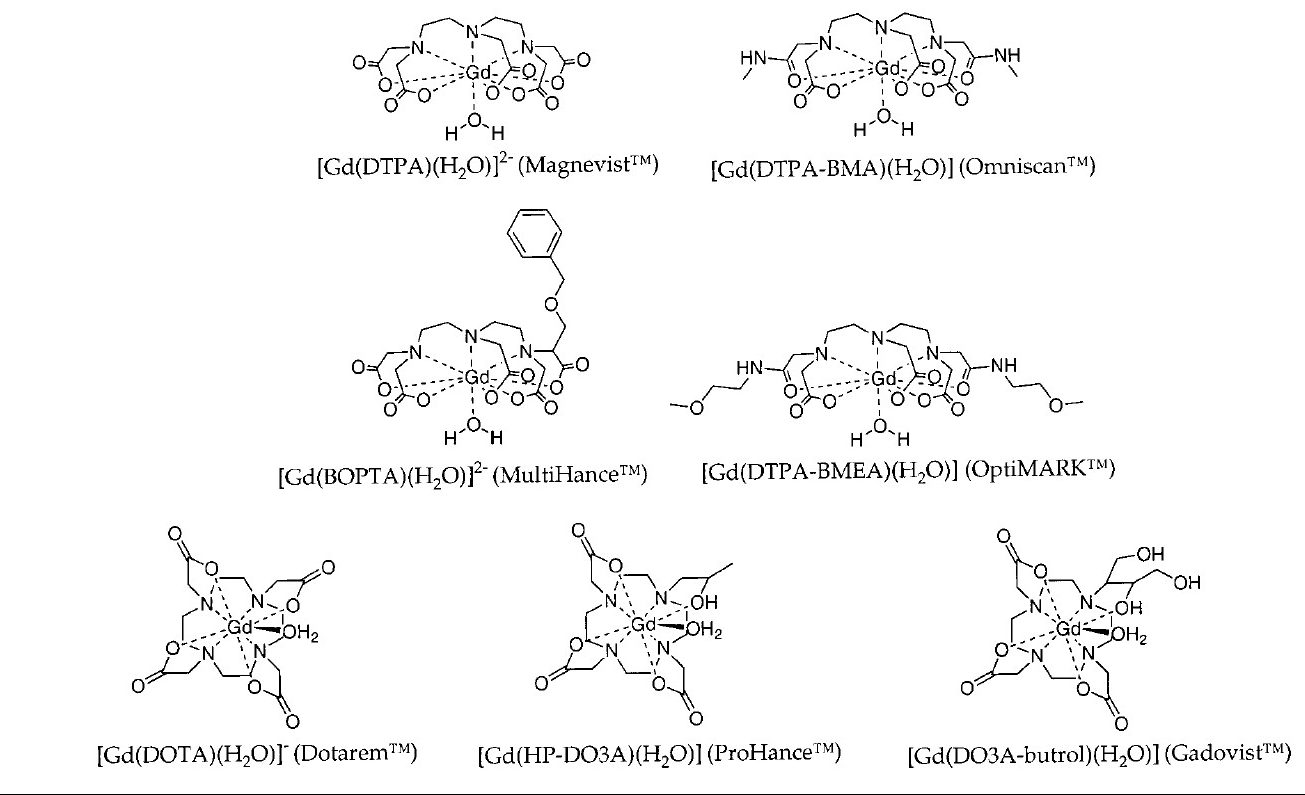
6 ماده حاجب Gd-DTPA, Gd-DTPA-BMA, Gd-DTPA-BMEA, Gd-DOTA, Gd-HP-DO3A و Gd-BT-DO3A تولیدات نسل اول نامیده می شوند و به صورت محلول در آب، با غلظت 0/5 M و دز 0/1 mmol/kg وزن بدن مورد استفاده قرار می گیرند. این ترکیبات در فضای خارج سلولی پخش می شوند، مختص بافت خاصی نبوده و به سرعت از کلیه ها دفع می شوند.
3 ترکیب دیگر Gd نسل دوم مواد حاجب MRI با پایه ی گادولینیوم را تشکیل می دهند. مواد حاجب Gd-EOB-DTPA و Gd-BOPTA مواد حاجب کبدی-صفراوی هستند و چون به وسیله ی سلول های کبدی جذب می شوند تشخیص ضایعات کبدی را آسانتر می کنند. MS-325 یک ماده ی حاجب شناور در خون است که میل زیادی برای ترکیب با آلبومین سرم خون دارد و نسبت به مواد حاجب قبلی زمان بیشتری را در عروق باقی می ماند.
ساختارهای حالت جامد
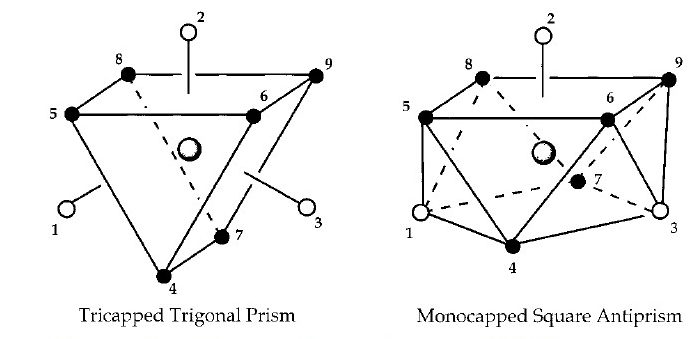
به دلیل اندازه ی بزرگ لانتانیدها تمایل زیادی برای پیون در مواد محلول در آن ها یافت می شود. اخیرا تمام کلات های با پایه ی Gd که مورد تایید قرار گرفته اند ترکیباتی 9 پیوندی می باشند که در آن ها لیگاند دارای 8 محل پیوند با فلز مرکزی می باشد و محل نهمین پیوند با یک مولکول آب از مولکول های حلال پر می شود. ساختار شیمیایی برخی کریستال ترکیبات گادولینیوم در شکل های زیر آمده است.
مکانیسم های آسایش ترکیبات Gd
برای کلات های کوچک Gd دو مولفه ی اصلی را می توان در مکانیسم های آسایش در نظر گرفت: مکانیسم حلقه ی داخلی (IS) به واسطه ی اتصال مولکول های آب به یون گادولینیوم به صورت مستقیم و مکانیسم حلقه ی خارجی که مربوط به به مولکول های منتشر در نزدیکی مرکز پارامغناطیس است.
برای برخی کلات ها یک مولفه ی دیگر به عنوان حلقه ی دوم (SS) تعریف می شود که به صورت کلی قابل چشم پوشی است. بنایراین اثر کلات Gd بر آهنگ آسایش طولی آب به وسیله ی فرمول زیر مشخص می شود:
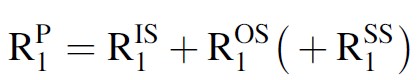
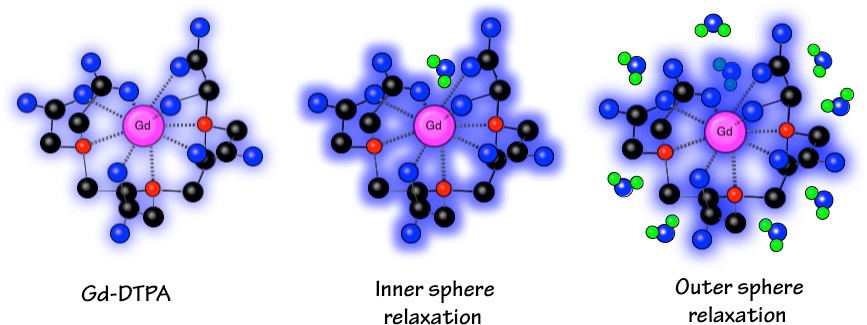
مکانیسم حلقه ی داخلی امکان انتشار اثر پارامغناطیس را از مرکز پارامغناطیس به محلول را فراهم می کند. این مکانیسم بر پایه ی جابجایی شیمیایی مولکول های آب در اولین حلقه ی پیوند یون گادولینیوم و مولکول های آب تشکیل دهنده ی محلول می باشد. آسایش حلقه ی خارجی به وسیله ی مولکول های آب آزاد تعریف می شود و ناشی از واکنش دو قطبی بین مولکول های منتشر نزدیک به یون Gd و خود یون Gd است. مکانیسم حلقه ی دوم به دلیل پروتون های مولکول های آبی که به شکل غیرمستقیم به مرکز پارامغناطیس متصل می شوند ایجاد می گردد.
ویژگی های کلی فیزیوشیمیایی
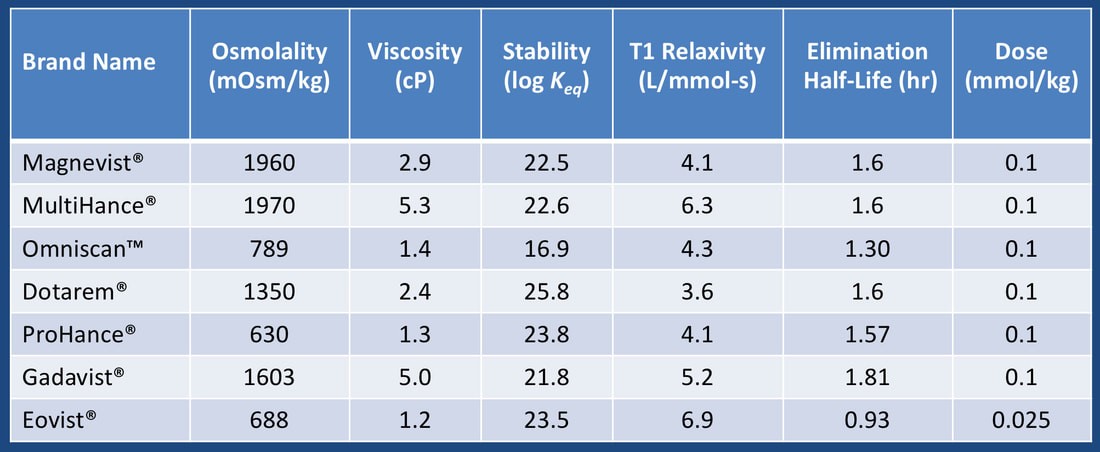
مواد حاجب MRI غیر از آسودگی که دارند، از نظر عملکردی در داخل بدن مانند داروها عمل می کنند. ویژگی های آن ها در داخل بدن شامل توزیع بافتی، ویژگی های دارویی و ایمنی آن ها می باشد. جدول زیر رایج ترین پارامترهای اندازه گیری شده مواد حاجب داخل وریدی را نشان می دهد. اختلاف در آبدوستی مواد حاجب بیشترین اثر را بر رفتار آن ها به صورت In vivo داراست. اسمولالیته و ویسکوزیته اصلی ترین عوامل مورد بررسی برای تعیین ایمنی و راحتی تزریق می باشند.
بررسی میزان آبگریزی مواد حاجب MRI نشان می دهد که این مواد به صورت کلی آبدوست هستند و این ویژگی آن ها سبب کاهش نفوذپذیری آن ها به داخل سلول و تحمل پذیری بیشتر بیمار می شود. اسمولالیته ی این مواد به صورت گسترده اندازه گیری شده است. جدول زیر کاهش اسمولالیته را در مواد حاجب غیریونی خارج سلولی نسبت به مواد حاجب یونی خارج سلولی را نشان می دهد. مطالعات بالینی به شکل قابل ملاحظه ای نشان داده اند که اختلاف چندانی در میزان اثرات جانبی مواد حاجب خارج سلولی وجود ندارد.
علاوه بر اسمولالیته، مواد حاجب غیریونی دارای ویسکوزیته ی پایین تری نیز هستند. این موضوع سبب می شود که هنگام تزریق سریع این مواد مزیت بیشتری برای آن ها در نظر بگیریم. ویسکوزیته ی پایین تر سبب کاهش فشار ناشی از تزریق این مواد به دیواره ی عروق می شود اما اختلاف قابل توجهی در سمیت عروقی بین مواد حاجب یونی و غیریونی به به چشم نمی خورد.
پایداری کلات های گادولینیوم
واضح است که انسجام مولکول های این مواد حاجب باید بالا باشد و در داخل بدن نباید از هم گسسته گردند. جدا شدن یون Gd از مولکول ماده ی حاجب نامطلوب است چرا که فلز آزاد شده و لیگاند گسسته شده به طور کلی سمی تر از ترکیب آن ها می باشد. یون فلزی آزاد شده تمایل زیادی برای پیوند با پروتیین های سرم انسان دارند و در نهایت بیشتر این یون های آزاد شده درون استخوان مستقر می شوند و پیوندی غیر قابل بازگشت را ایجاد می کنند. تشخیص مقدار زیادی یون گادولوینیوم در بافت استخوانی، معمولا به وسیله ی ICP یا گاما، بیانگر جداشدن یون Gd از کلات آن می باشد.
منبع:MRI Contrast Agents From Molecule to Particles





