APT-weighted MRI Neuro Applications
Brain Tumors
پر استفاده ترین کاربرد APTw MRI در مطالعه ی تومورهای مغزی بوده است که در حال آغاز کار برای تشخیص تومور، گریدبندی، ارزیابی عود تومور در مقابل اثرات درمان و شناسایی نشانگر ژنتیک تومور می باشد. ارزش افزوده ی APTw MRI در انهنس نمودن تشخیص غیرتهاجمی مولکولی تومورهای مغزی می تواند به صورت بالقوه در درمان های تحت گاید مانند جراحی، رادیوتراپی و شیمی درمانی موضعی کمک کننده باشد.
Detecting Tumors
سکانس های استاندارد MRI (مانند T2w، FLAIR) به صورت موثر اختصاصی بافت نبوده و دارای چندین محدودیت هستند. برای مثال هنگام تشخیص گلیوماها سیگنال بالای T1 هم می تواند نشاندهنده ی نفوذ تومور و هم ادم وازوژنیک باشد. انهنسمنت گادولینیوم می تواند نواحی مرکزی گلیوماهای بدخیم را در نواحی که سد خونی-مغزی آسیب دیده است، آشکار نماید اما نمی تواند تمامی نواحی نفوذ تومور با ساختار متراکم و تکثیر بالا را نشان دهد یا ممکن است چند ناحیه ی تومورال را با درجات پایین انهنسمنت آشکار کند که سبب تشخیص اشتباه گردد. بنابراین با توجه به مکان واقعی تومور، روش های استاندارد MRI اغلب برای جراحی موفق یا درمان های موضعی دیگر مناسب نیست. چندین پژوهش حول توانایی های تصویربرداری عملکردی و مولکولی MRI برای ارزیابی نواحی تومورال مغزی درحال انجام است. فناوری APTw MRI برای تصویربرداری از تومورهای مغزی در سال 2003 معرفی شد. اطلاعات برروی چندین مدل تومور جانوری به وضوح سیگنال بالای APTw را در تومور نشان داده اند. 3 سال بعد تصویربرداری APTw برروی بیماران دارای تومور مغزی انجام گردید و افزایش سیگنال در نواحی تومورال با گرید بالا نشان داد (شکل1). در حقیقت گاهی نواحی با سیگنال بالا در تصاویر APTw بزرگتر از نواحی انهنس شده پس از تزریق ماده ی حاجب در تصاویر T1 و کوچکتر از نواحی مربوط به تومور در تصاویر T2 و FLAIR می باشند. تعداد زیادی مطالعه از موسسات مختلف نشان داده اند که تصویربرداری APTw می تواند ارزش بالایی در تشخیص تومورهای مغزی داشته باشد.
به صورت نظری، سیگنال بالای گلوماها در تصاویر APTw می تواند به دلیل محتوای پروتیین Cytosolic یا افزایش pH داخل سلولی باشد. در این حالت بیان اینکه هیچ ارتباطی بین آهنگ جایگزینی پروتون آمید و pH خارج سلولی اندازه گیری شده در یک آزمایش CEST با ماده حاجب اگزوژن وجود ندارد اشتباه است. همانگونه که اخیرا نشان داده شد، افزایش محتوای پروتیین درون تومور، محتمل ترین توضیح است چرا که اغلب مقدار pH به میزان کمی افزایش می یابد. به هرروی افزایش مقدار pH درون سلولی میتواند عامل بهبود دهنده ی تشخیص تومور باشد. یک عامل احتمالی تشدید کننده ی سیگنال بالای APTw دیگر در تومور می تواند رگزایی باشد، چراکه خون شامل مقادیر بالایی از همگلوبین و آلبومین است.
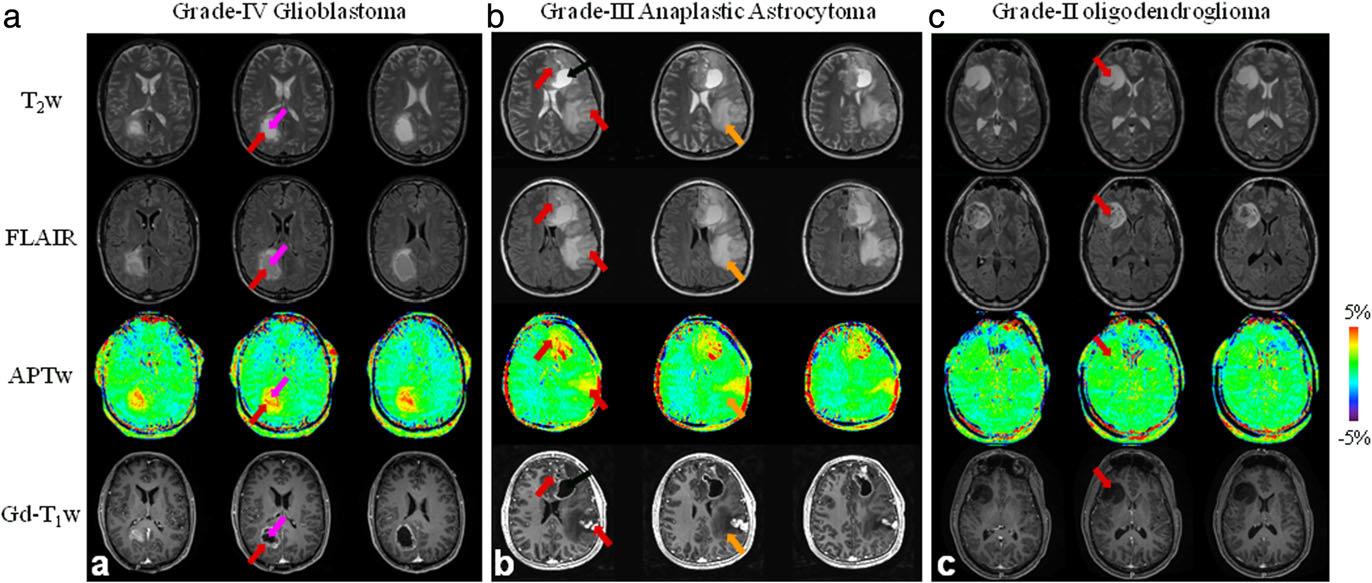
شکل 1. a) تصاویر APTw و معمولی MRI در بیمار مبتلا به glioblastoma. b) تصاویر APTw و معمولی MRI در بیماری مبتلا به multifocal grade-3 anaplastic astrocytoma. c) تصاویر APTw و معمولی MRI در بیمار مبتلا به low-grade glioma.
Grading Tumors
نتایج اولیه ی بالینی در اسکنرهای 3T از چندین آزمایشکاه نشان داده اند که سیگنال بالای APTw (چه حلقه مانند و چه نقطه ای) ویژگی رایج گلیوماهای با گرید بالا (گریدهای 3 و4) می باشد. تصویربرداری MRI پس از تزریق ماده ی حاجب در برابر برخی تومورهای با گرید بالا (10 درصد از گلیوماها و 30 درصد از آستروسایتوماهای آناپلاستیک) که انهنس نمی شوند دارای نقص است علاوه براین انهنسمنت گادولینیوم همواره مختص گلوماهای با گرید بالا نبوده و گاهی گلیوماهای با گرید پایین نیز انهنس می شوند. یک مطالعه ی با استفاده از بیوپسی استریوتاکتیک تحت هدایت APTw توسط Jiang و همکارانش نشان داد که تصویربرداری APTw می تواند نواحی با گرید بالا را درون گلیوماهای یکنواخت شناسایی نموده و امکان نمونه برداری دقیق تر از این نواحی را فراهم کند. از سوی دیگر در بیماران دارای گلیوماهای با گرید پایین که توسط پاتولوژی تایید شده اند (شامل ضایعاتی که که پس از تزریق ماده ی حاجب انهنس شده اند)، تصویربرداری APTw نواحی isointense یا hyperintense نقطه نقطه ی پراکنده ای را درون ضایعه نشان می دهد. این یافته های اولیه توسط محققین تایید شده اند و نشان می دهند که تصویربرداری APTw برای تبدیل شدن به یک بیومارکر تصویربرداری به منظور جداسازی گلیوماهای با گرید بالا و پایین و همچنین تشخیص تومورهای باگرید بالا که با گادولینیوم انهنس نشده اند یا تومورهای با گرید پایین که به صورت کاذب انهنس شده اند، در تومورهای بدخیم مغزی دارای پتانسیل بالایی است.
Distinguishing Active Glioma From Treatment Effects
یک مانع بزرگ در مدیدریت گلیوماهای بدخیم و بسیاری از تومورهای مغزی دیگر عدم توانایی بیشتر روش های تصویربرداری کنونی در ارزیابی پاسخ تومور به درمان است. در یک مطالعه ی پیش بالینی توسط Zhou و همکارانش از موش هایی که درون مغزشان به وسیله ی پرتو بافت نکروز ایجاد شده است نشان داده شد که نواحی نکروز شده نسبت به بافت نرمال سمت مقابل به صورت isointense یا hypointense در تصاویر APTw MRI مشاهده می شوند. در این مورد، تفسیر به این صورت بود که این کاهش سیگنال به دلیل عدم وجود پروتیین های موبایل Cytosolic سیتوپلاسمی و ارگانل های می باشد. هنگام ارزیابی پرتودرمانی در بیماران دارای گلیوما همانگونه که از تصاویر T2 برمی آمد، مشاهده شد که تومورهای بزرگ بزرگ منتشر شده اند درحالیکه سیگنال آن ها در تصاویر APTw کاهش یافته است. این مطالعه و مطالعات پس از آن نشان داده اند که تصویربرداری APTw یک روش ویژه برای ارزیابی پاسخ تومور به رادیوتراپی، شیمی درمانی و درمان موضعی با اولتراسوند می باشد.
امروزه چندین مطالعه ی بالینی توانایی تصویربرداری APTw را در افتراق عود تومور از اثرات درمان تایید نموده اند. این نتایج اولیه پتانسیل تصویربرداری APTw را در neuro-oncology نشان می دهند. برای مثال Zhou و همکارانش یک سکانس 3D APTw را در بیمارانی که از نظر بالینی مشکوک به پیشرفت تومور پس از شیمی درمانی بودند، به کار گرفتند. از این مطالعه دریافت شد که پیشرفت حقیقی تومور همراه با افزایش خفیف سیگنال APTw است، درحالیکه پیشرفت کاذب در تصاویر APTw دارای سیگنال همگن یا اندکی سیگنال بالاتر می باشد (شکل 2). مطالعه دیگری نشان داد که شدت سیگنال APTw به شکل قابل توجهی در مقایسه با نواحی غیرفعال در نواحی که تومور فعال وجود دارد بالاتر بوده و این دو گروه را می توان با حساسیت 85/1٪ و specifity=%94/1 از یکدیگر افتراق داد. به علاوه این مطالعه از این فرضیه که سیگنال بالای APTw برای گلیومای فعال می تواند به عنوان یک بیومارکر جایگزین به منظور افتراق تومور عود کرده از اثرات درمان شناخته شود، حمایت نمود. تصویربرداری APTw پتانسیل بهبود تشخیص افتراقی غیر تهاجمی در این دو پاتولوژی را داراست. این موضوع در بلند مدت می تواند لزوم بیوپسی های تکراری را کاهش داده و به تبع آن خطرات مربوط به آن را نیز از بین ببرد.
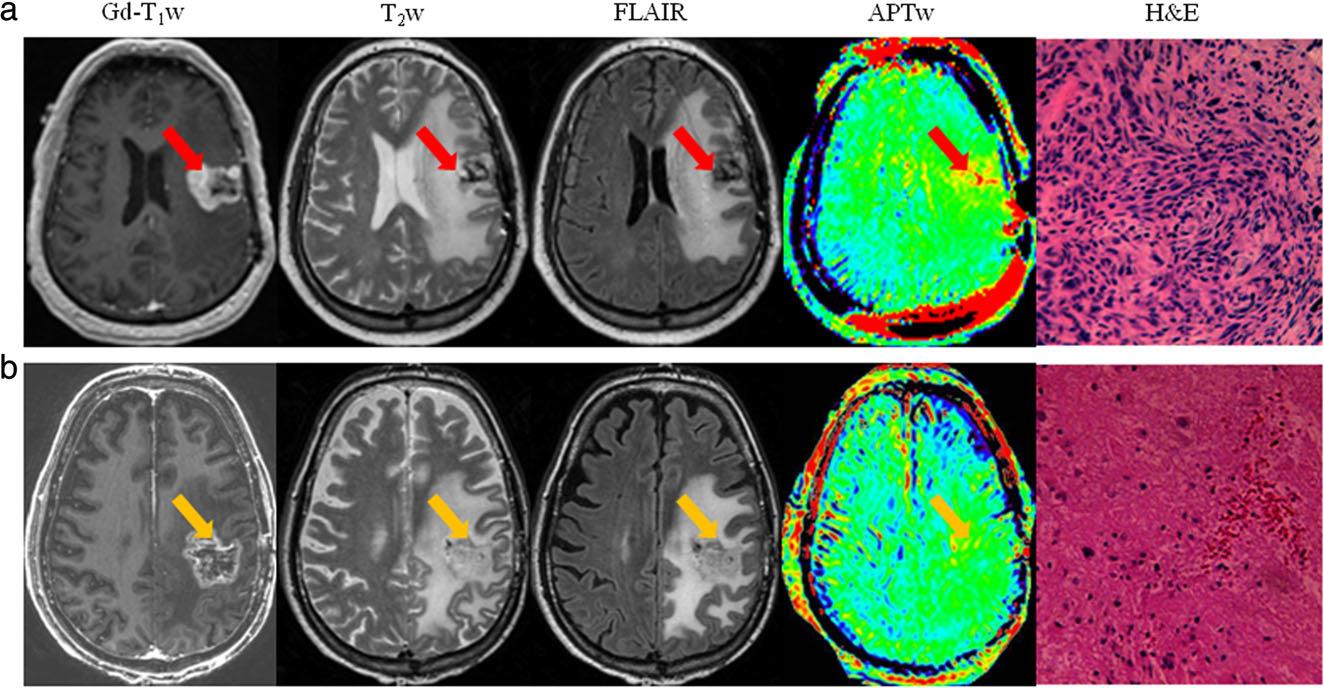
شکل 2. a) تصاویر معمولی MRI، APTw و هیستولوژی در بیمار دارای پیشرفت تومور. b) تصاویر معمولی MRI، APTw و هیستولوژی در بیمار با تشخیص بالینی پیشرفت کاذب تومور.
Identifying Genetic Markers In Gliomas
جدیدترین رده بندی WHO در سال 2016 از تومورهای سیستم عصبی مرکزی، علاوه بر هیستولوژی تومور، از مارکرهای مولکولی نیز برای بیان ویژگی های تومور استفاده نموده است. تاکنون MRS تنها روش in vivo برای ارزیابی وضعیت موتاسیون IDH از طریق اندازه گیری سطح 2-Hydroxyglutarate (2-HG) بوده است. با اینحال تشخیص 2-HG در MRS در گلیوماهای دارای موتاسیون IDH نیازمند وجود تومورهای بزرگ و متعاقب آن زمان زیاد برای انجام می باشد که آن را از نظر کاربرد بالینی محدود می کند. در دو مطالعه ی جدید گذشته نگر، Jiang و همکارانش نشان دادند که تصویربرداری APTw پتانسیل به کار گیری در به عنوان یک بیومارکر تصویربرداری را برای شناسایی وضعیت موتاسیون IDH در گلیوماهای با گرید پایین و وضعیت MGMT در گلیوماهای با گرید بالا را دارا است. نتایج اولیه ی تصویربرداری APTw نشان دادند که ضایعات با موتاسیونIDH wild type در مقایسه با ضایعات دارای موتاسیون IDH در تصاویر APTw دارای سیگنال بالاتری هستند.
Stroke
دو نوع اصلی استروک وجود دارد: ایسکمیک و هموریجیک. ماهیت ذاتی APTw در رابطه با حساسیت نسبت به pH و فراهم آوری اطلاعاتی درباره ی محتوای پروتیین بافت امکان استفاده از این تصویربرداری در ارزیابی تدریجی تغییرات pH در طول ایسکمی اولیه و نشت خون به بافت ها را در طول خونریزی فراهم می کند.
Detecting Ischemic Stroke
امروزه تنها راه درمان استروک ایسکمیک برطرف نمودن انسداد عروق منتهی به نواحی درگیر است که هنوز زنده هستند. با استفاده از تصاویر DWI و PWI و عدم تطابق بین نواحی ناهنجاری در آن ها برای مدت ها برای تشخیص ناحیه ی پنامبرا مورد استفاده قرار می گرفت ام این روش به دلیل محدودیت هایش منسوخ گردید. از آنجایی که متابولیسم بی هوازی و اسیدی شدن بافت به عنوان اولین علامت ایسکمی در بافت در معرض خطر شناخته می شود انتظار می رود که تصاویر APTw بتواند نواحی پنامبرا را بدون محدویت های روش پیشین تشخیص دهد. Zhou و همکارانش ابتدا وجود اثرات APTw را در یک مدل جانوری استروک در سال2003 نشان دادند که کاهش ![]() بافت مغزی پس از مرگ مربوط به کاهش pH و به تبع آن کاهش آهنگ جایگزینی می باشد. در مورد ایسکمی، تصاویر با وزن pH (pHw) نامیده می شوند. Sun و همکارانش استفاده از APTw MRI با پایه ی pH را برای تشخیص یک پنامبرا با پایه ی اسیدی توصیه کردند.
بافت مغزی پس از مرگ مربوط به کاهش pH و به تبع آن کاهش آهنگ جایگزینی می باشد. در مورد ایسکمی، تصاویر با وزن pH (pHw) نامیده می شوند. Sun و همکارانش استفاده از APTw MRI با پایه ی pH را برای تشخیص یک پنامبرا با پایه ی اسیدی توصیه کردند.
در 12 سال اخیر تصویربرداری APTw در این بیماران با شدت بالایی صورت گرفته است که نتایج به دست آمده ی اولیه را تایید می نمایند. برای مثال Harston و همکارانش در یک مطالعه ی آینده نگر از 12 بیمار مبتلا به استروک حاد نشان دادند که وکسل های درون هسته ی ایسکمی دارای اسیدوز داخل سلولی شدیدتری نسبت به بافت دارای پرفیوژن پایین که در انتهای اینفارکت ایجاد می شود، می باشد. علاوه براین هنگام محدود کردن موضوع به نقص پرفیوژن در بافت خاکستری، pH داخل سلولی در بین بافت هایی که از قبل اینفارکت شده اند و بافت هایی که نجات یافته اند متفاوت است درحالیکه مقدار CBF در آن ها یکسان است. با اینحال برخلاف نتایج به دست آمده در مطالعه ی تومورهای مغزی میزان اثر تغییرات سیگنال APTw در این بیماران نسبتا کوچک بوده و متقاعد کننده نیستند.
Differentiating Ischemic From Hemorrhagic Stroke
تشخیص سریع و دقیق استروک هموریجیک با استفاده از تصویربرداری عصبی برای تمام این بیماران دارای اهمیتی زیادی است. در بالین این امر مهم با استفاده از CT Scan حاصل می شود اما اخیرا نشان داده شده است که APTw MRI نیز می تواند برای شناسایی خونریزی داخل مغزی و افتراق ICH و ایسکمی در مراحل فوق حاد در مدل های جانوری مورد استفاده قرار گیرد. تصویربرداری APTw MRI در ضایعات ICH، سیگنال بالا نسبت به بافت نرمال سمت مقابل مغز و در ضایعات ایسکمی سیگنال پایین را ایجاد می کند. در خونریزی فوق حاد هماتوم پس از پارگی رگ شامل مجموعه ای از گلبول های قرمز (که دارای مقادیر بالای هموگلوبین هستند) گلبول سفید، انبوه پلاکت ها و سرم غنی از آلبومین می باشد. بنابراین منتج می شود که سیگنال بالای APTw در خونریزی فوق حاد منعکس کننده ی وجود مقادیر بالای پروتیین و پپتیدهای متحرک است. سیگنال بالای APTw در خون همچنین در نمونه های خالص خون، عروق خونی و بسیاری از ضایعات مغزی گزارش شده است. اخیرا APTw، در بالین، برای تشخیص ICH در فازهای فوق حاد، حاد و تحت حاد مورد استفاده قرار گرفته است. این نتایج نشان می دهند که APTw پتانسیل تشخیص و افتراق ICH فوق حاد مغزی از ایسکمی مغزی را داراست و امکان استفاده از تنها یک اسکن منفرد، برای مشاهده ی تدریجی و جداسازی ضایعات ایسکمی و هموریجیک را در مرحله ی فوق حاد فراهم می کند.
Other Neurological Applications
بیماری آلزایمر (AD) یک عارضه ی غیر قابل برگشت مغزی و مربوط به سن است که به واسطه ی تجمع پلاک های خارج سلولی آمیلویید و neurofibrillary tanglies داخل سلولی شناسایی می شود. Wang و همکارانش در یک مطالعه ی جدید امکان استفاده از APTw برای تشخیص ناهنجاری مغزی در بیماران آلزایمر و افتراق شدت های مختلف ابتلا در بیماران بررسی کردند. تصویربرداری APTw دو طرفه از هیپوکامپ یک روند افزایشی را در شدت های بالای سیگنال از بیماران گروه کنترل، گروه خفیف تا موارد میانه و شدید بیماری آلزایمر نشان داد. این نتایج اولیه پیشنهاد می کنند که تصویربرداری APTw می تواند در تشخیص زود هنگام آلزایمر و نظارت بر پیشرفت بیماری به صورت غیر تهاجمی ارزشمند است.
بیماری پانکینسون (PD) یک بیماری neurodegenerative است که به واسطه ی کاهش دوپامین در نورون های تولیدکننده ی دوپامین در substantia nigra شناسایی می شود. تشخیص PD به ویژه در مراحل اولیه همچنان چالش برانگیز باقی مانده است. Li و همکارانش امکان استفاده از تصویربرداری APTw در بیماران مبتلا به پارکینسون را با استفاده از یک سیستم 3T مورد آزمایش قرار دادند (شکل 3). در بیماران مبتلا به پارکینسون شدت سیگنال APTw در نواحی substantia nigra و red nucleus نسبت به بیماران گروه کنترل کاهش یافته بود (اگرچه این کاهش در red nucleus قابل توجه نبود). به صورت کمی شدت سیگنال CEST در substantia nigra روند نزولی با ثباتی را در بیماران نسبت به افراد گروه کنترل و افراد دارای مراحل اولیه ی بیماری نشان داده است. علاوه براین مقدار کاهش در افراد مبتلا و دارای سیمپتوم های یک طرف به شدت پایینتر بود. از سوی دیگر در نواحی globus pallidus ، Putamen و caudate شدت سیگنال های APTw در بیماران مبتلا به پارکینسون افزایش یافته بود. این نتایج و نتایج مربوط به مطالعات بیماری آلزایمر نشان می دهند که تصویربرداری APTw پتانسیل به کار گیری به عنوان یک بیومارکر تصویربرداری را داراست که می تواند بیماری های neurodegenerative را تشخیص داده و به جلوگیری از پیشرفت آن ها کمک کند.
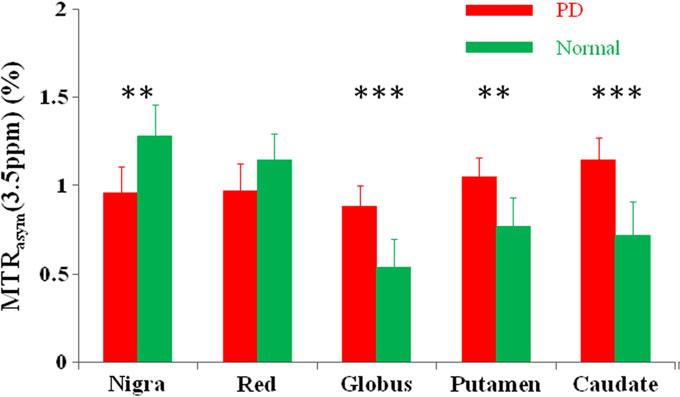
شکل 3.
مالتیپل اسکلروزیس (MS) یک بیماری neurodegenerative است که به وسیله ی التهاب مزمن سیستم عصبی مرکزی و ایجاد ضایعات پلاک مانند در چند بافت به ویژه بافت سفید سیستم عصبی مرکزی شناسایی می شود. این پلاک ها به دلیل حذف میلین آکسون ها می باشد که ممکن است تا صدمه به آکسون ها پیش رود. گزارش های اولیه از به کارگیری تصویربرداری APTw در مغز و نخاع بیماران مبتلا به MS نتایج مختلفی را نشان می دهند. در این مطالعات افزایش سیگنال APTw در ضایعات مغز و نخاع مشاهده شد اما یک جابجایی به سمت محدوده ی پایین هیستوگرام در نخاع به چشم می خورد. افزایش سیگنال در تصاویر APTw احتمالا ناشی از تجزیه ی پروتیین ها و ایجاد پروتیین های کوچکتر بوده است اما نتیجه گیری کلی خواهان مطالعات و بررسی های بیشتر است. پژوهش برروی اصل جابجایی مغناطیسی به واسطه ی کاهش MTC حاصل از حذف میلین و کاهش کلی شدت طیف Z در ضایعات، به همراه افزایش محتوای آب، محدود می شود. بنابراین مطالعات آینده باید به گونه ای طراحی شوند که این عوامل دخیل را حذف کنند.
آسیب مغزی تروماتیک (TBI) ممکن است به صورت صدمه ی اولیه (مانند کانتوژن، خونریزی و صدمه ی منتشر آکسونی) و یا ثانویه (مانند ایسکمی مغزی) باشد. Zhang و همکارانش در یک مطالعه ی جدید ویزگی منحصر بفردی از سیگنال APTw در دوره های مختلف پس از آسیب همراه با ایسکمی (کاهش سیگنال نسبت به بافت نرمال سمت مقابل مغز)، خونریزی (افزایش سیگنال) و التهاب عصبی (افزایش سیگنال) را نشان دادند. برخلاف بسیاری از تکنیک های پیشرفته ی MRI که اخیرا مورد استفاده قرار می گیرند، تصویربرداری APTw می تواند به صورت بصری (نه فقط اختلاف آماری در تحلیل تصاویر) برای این ویژگی مهم TBI فراهم کند. مطالعه ی دیگری که توسط Wang و همکارانش برروی این بیماران و تاثیر pinocembrine برروی آن ها را بررسی نمود نیز پتانسیل این تصویربرداری برای تشخیص این عارضه و تاثیر دارو برروی آن را داراست. این یافته های الولیه بیان می کند که سیگنال APTw میتواند یک بیومارکر تصویربرداری حساس برای بررسی التهاب عصبی و پاسخ ضد التهابی در TBI باشد که می تواند به صورت بالقوه برای ارزیابی کارایی درمان در این بیماران مورد استفاده قرار گیرد.
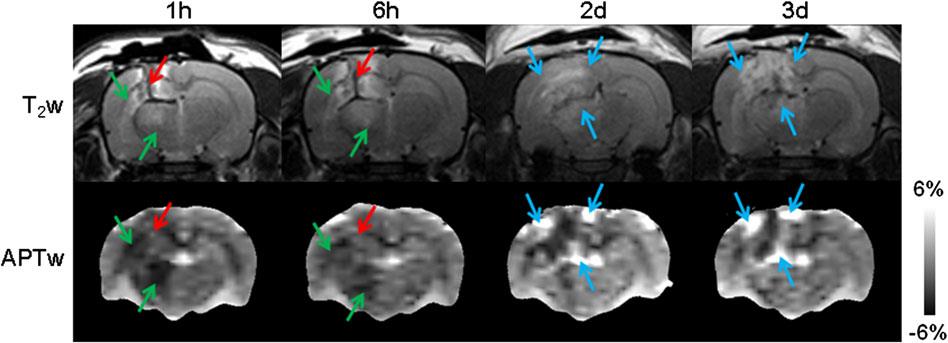
شکل 4. یک مثال معمولی تصاویر T2 و APTw از TBI در موش و در زمان های مختلف.





