|
(Review) مروری Open Access |
|
Te Riele AS, Tandri H, Bluemke DA. Arrhythmogenic right ventricular cardiomyopathy (ARVC): cardiovascular magnetic resonance update. J Cardiovasc Magn Reson. 2014 Jul 20;16(1):50. |
کاردیومیوپاتی آریتموژنیک بطن راست (ARVC): بازبینی ام آر آی قلبی عروقی
(In the Corresponding Language )
Anneline SJM te Riele, Harikrishna Tandri and David A Bluemke
| چکیده
کاردیومیوپاتی آریتموژنیک بطن راست (ARVC) یکی از شایع ترین اشکال ایجاد کننده آریتمی از کاردیومیوپاتی های ارثی است و یک علت شایع مرگ ناگهانی در جوانان است. افراد مبتلا بطور تیپیک بین دهه دوم و چهارم زندگی با آریتمی هایی با منشا بطن راست مراجعه می کنند. جهش های پاتولوژیک و ژنهای کد کننده دسموزوم قلب میتواند در تقریبا ۶۰% بیماران مبتلا دیده شود، که این باعث دیدگاه فعلی ما از ARVC به عنوان یک بیماری دسموزومال شده است. اگرچه ARVC به این عنوان شناخته شده که ترجیحا ابتدا بطن راست را درگیر می کند و یا بطور فزاینده ای با درگیری غالب بطن چپ تشخیص داده میشود. تشخیص بر اساس ترکیبی ازچندین منبع اطلاعات تشخیصی است که توسط معیارهای “Task Force” توصیف شده است. تحقیقات اخیرپیشنهاد میکند که اختلالات الکتریکی قبل از تغییرات ساختاری در ARVC بروز می کنند. ام آر آی قلبی عروقی (CMR) یک روش ایده آل در بررسی های ARVC است، و آن میتواند اطلاعات جامعی از مورفولوژی قلبی، عملکرد و خصوصیات بافتی در یک مطالعه واحد فراهم کند. پیشگیری از مرگ ناگهانی قلبی با استفاده از تعبیه دفیبریلاتور قلبی مهم ترین تصمیم درمانی است. هدف از این مقاله آنست که یک مطالعه بازبینی شده از دانش ما در زمینه ژنتیک، تشخیص، جایگاه فعلی انجام و انالیز CMR، و اداره بیماران با ARVC را فراهم آورد.
کلمات کلیدی: کاردیومیوپاتی آریتموژنیک بطن راست، ام آر آی قلبی عروقی، تشخیص، ژنتیک، درمان
|
مقدمه
کاردیومیوپاتی آریتموژنیک بطن راست (ARVC) یک کاردیومیوپاتی ارثی است که مشخصه آن جایگزینی فیبر-چربی بصورت برجسته درمیوکارد بطن راست (RV) است، که بیمار را مستعد آریتمی های تهدید کننده حیات و اختلال عملکرد بطن راست می کند [۱-۳] . ARVC در ۲۰% از افراد با سابقه مرگ ناگهانی قلبی (SCD) قبل از ۳۵ سال تظاهر میکند و حتی بیشتر در ورزشکاران با مرگ ناگهانی دیده می شود [۲,۴] . شیوع این بیماری ۱ در هر ۲۰۰۰ تا ۵۰۰۰ مورد گزارش شده است، اگرچه برخی از گزارشات تخمین میزنند که شیوع واقعی آن در برخی از مناطق خاص دنیا میتواند ۱ در هر ۱۰۰۰ نفرباشد که به دلیل کم تشخیص داده شدن است [۵,۶] . درطی دهه ی گذشته، تست های ژنتیک برای جهش های وابسته به ARVC در پنج ژن دسموزومال و چندین ژن غیردسموزومال از نظر بالینی در دسترس بوده اند [۷]. به طور تیپیک وراثت به صورت اتوزومال غالب با قدرت نفوذ ناکامل و بیان متفاوت است [۷-۹]. به طور کلاسیک بیماران مبتلا در بین دهه های دوم و چهارم زندگی با آریتمی های بطنی ناشی از بطن راست تظاهر می یابند [۳]. با اینحال، SCD به طور زودرس در نوجوانی هم میتواند رخ می دهد، در حالی که حامل های جهش ممکن است در تمام طول زندگی بدون علامت باقی بمانند [۳,۱۰,۱۱].
روش های تصویربرداری که به طور روتین برای ارزیابی ARVC مورد استفاده قرار می گیرد شامل اکوکاردیوگرافی، ام آر آی قلبی عروقی (CMR)، و آنژیوگرافی RV است. هم اکوکاردیوگرافی و هم آنژیوگرافی محدودیت های چشمگیری در ارزیابی RV به دلیل مسائل هندسی پیچیده آن دارند [۱۲].از دهه ی گذشته،CMR به عنوان یک ابزار تصویربرداری انتخابی در ARVC پدیدار شده است، که امکان بررسی های مورفولوژیکی و عملکردی غیرتهاجمی، بعلاوه آنالیز خصوصیات بافتی را در یک مطالعه واحد می دهد [۱۳,۱۴]. برخلاف شیوع پایین، ARVC یک درصد بالای نامتناسب ارجاع برای انجامCMR به شمار می رود. متاسفانه، بسیاری از مراکز تصویربرداری تجربه اندکی برای ارزیابی ARVC دارند، و کسب تجربه نیز به دلیل شیوع پایین بیماری دشوار می باشد. هدف از این مقاله مرور دانش فعلی از ARVC است که برای تفسیر CMR در ARVC مفید می باشد. تاکید ما بر بازبینی مسائل مربوط به تشخیص ARVC با CMR است [۱۵]، که شامل معیارهای تشخیصی ARVC و نواحی رایج غیرطبیعی عملکردی و مورفولوژیکی در این بیماری است.
بازبینی تشخیص ARVC
تشخیص ARVCاحتمالا چالش برانگیز خواهد بود چراکه هیچ روش اختصاصی منفرد و مناسبی برای اثبات تشخیص ARVC وجود ندارد. از این رو، منابع مختلفی از اطلاعات تشخیصی در مجموعه پیچیده ای از معیارهای تشخیصی ترکیب شده اند. معیارهای اصلی “Task Fore” (TFC)، در سال ۱۹۹۴ تعریف شده است [۱۶]،که بخش اصلی آن تکیه بر پارامترهای کیفی است و غیر حساس برای بیماری خصوصا در مراحل اولیه نشان داده شده است [۱۷-۲۰]. بعلاوه، معیارهای تصویربرداری اختصاصی نبودند، و منجر به تشخیص های مثبت کاذب فراوان می شدند. در سال ۲۰۱۰، اصلاحات برای معیارها پیشنهاد شده اند (جدول۱) [۲۱]. این اصلاحات دو هدف داشتند: (۱) برای بهبود اختصاصیت معیارهای تشخیصی به وسیله شامل شدن معیارهای کمی برای تشخیص ARVC، و (۲) برای بهبود حساسیت تشخیص در افرادی که احتمال بالای بیماری های ژنتیکی/ ارثی را دارند. خصوصا، پارامترهای کمی که شامل بر معیارهای تصویربرداری، بیوپسی اندومیوکارد، و ( سیگنال متوسط) ECG می باشند. بعلاوه، در حال حاضر TFC تجدید نظر شده، شامل بر جهش های پاتوژنیک وابسته به ARVC به عنوان یک معیارهای ماژور برای تشخیص ARVC می باشد. این تغییرات برای TFC منجر به افزایش حساسیت برای بیماری های ژنتیکی/ ارثی شده است، در حالی که یک ویژگی رضایتبخشی باقی مانده است [۲۲-۲۴].
نقش CMR در تشخیص ARVC
پروتکل CMR برای ARVC
پروتکل CMR را که ما برای ارزیابی ARVC پیشنهاد می کنیم در جدول ۲ نشان داده شده است. پروتکل برای ارزیابی RV از نظر ساختار و خصوصیات بافتی غیرطبیعی با توانایی ارزیابی کمی طراحی شده است. برای تصویربرداری بصورت خون سیاه، تصویربرداری با رشته پالس سریع اسپین اکو یا توربو اسپین اکو مطلوب می باشند. بهترین ارزیابی دیواره آزاد RV و مسیرخروجی RV در تصاویر آگزیال خون سیاه انجام شده است. دسته تصاویر آگزیال باید شامل تمام قسمت های RV باشد. این می تواند در ۶-۸ مقطع با فواصل حدودا یک سانتی متر باشد (ضخامت اسلایس + گپ). بیشتر اطلاعات تشخیصی از مقاطعی که در وسط حفره RV گرفته می شوند، بدست می آیند. به دست آوردن تعداد زیادی از تصاویر مقاطع منجربه طولانی شدن بررسی خواهد شد. برای تصویربرداری متحرک، تصاویر (steady state free precession (SSFP در ۱٫۵ تسلا ترجیح داده می شوند. اطلاعات کافی از ۳ تسلا در دسترس نیست تا مشخص شود SSFP یا گرادیانت اکو سریع (FGRE[1]) کدام برتر است. آنالیزهای کمی RV و بطن چپ (LV) در تصاویر محوری کوتاه انجام می شود. بدین گونه که، ۱۲-۱۰ مقطع که حجم کامل بطن را احاطه می کند باید به دست آیند. ما توصیه میکنیم شروع تصاویر نزدیک به ۱ سانتی متر بالای سطح دریچه باشد وبه سمت نوک بطن پیشرفت انجام گیرد. تصاویر متحرک باید در محورهای طولی از LV به دست آید. برخی مراکزیک نمای محوری عمودی طولی از RV را ترجیح می دهند. در نهایت، ما به طور معمول یک دسته از تصاویر سرتاسری اگزیالRV در همان موقعیت مقطع که درتصاویر خون سیاه در بالا توضیح دادیم می گیریم. با ارائه اسکنرهای مدرن CMR ، رزولوشن های زمانی در تصاویر متحرک به طور حدود ۴۰ میلی ثانیه است. تصاویر گادولینیوم تاخیری با استفاده از تصاویر اینورژن ریکاوری حساس به فاز(PSIR[2]) که توالی رشته پالسی است که مستقل از شناسایی دقیق زمان اینورژن (TI) می باشد، بهتر بدست می آید [۲۱]. در بیمارانی با ضربان نابجای بطنی قابل توجه ، یک دوز پایین از بتابلوکر (متوپرولول ۲۵-۵۰ میلی گرم) برای سرکوب آریتمی در طی اسکن CMR توصیه می گردد.
CMR TFC و مشتق هایشان
یک ضمیمه ماژور برای TFC تجدید نظر شده شامل سنجش های کمّی برای معیارهای تصویربرداری است.CMR TFC تجدید نظر شده در حال حاضر نیاز به وجود یافته های کیفی (آکینیزی ناحیه RV، دیس کنیزی، عدم انقباض هماهنگ) و یافته های کمّی (کاهش کسر تخلیه ای یا افزایش اندکس حجم پایان دیاستولRV است) (جدول ۱).مقادیر کمی حجم و عملکرد RV برای TFC که از مقایسه فرد شاخص ARVC با داوطلب های سالم نرمال که در مطالعه آترواسکلروز با نژادهای گوناگون (MESA[3]) بودند مشتق می شود[۲۶] . برای تعیین مقادیرحد مرز، اندازه و عملکرد RV در۴۶۲ شرکت کننده نرمال MESA با ۴۴ proband در فهرست ثبت امریکای شمالیARVC مقایسه شدند [۲۱]. کرایتریای ماژور (کسر تخلیه ای RV ≤۴۰% یا ایندکس حجم پایان دیاستول ≥۱۱۰ ml/m2 برای مرد و ≥ ۱۰۰ml/m2 برای زن) برای دستیابی به ۹۵% اختصاصیت انتخاب شده است. حد مرزی ها با اختصاصیت بالاترمنجر به کاهش حساسیت میشود؛ معیارهای ماژور CMR یک حساسیت ۶۸ تا ۷۶% دارد [۲۷]. معیارهای مینور ( کسر تخلیه ای RV 45-40% یا ایندکس حجم پایان دیاستول RV 110-100 ml/m2 برای مرد و ۱۰۰-۹۰ ml/m2 برای زن) حساسیت بالاتری دارد (۷۹ تا ۸۹%)، اما نتیجتا ویژگی پایین تری دارد (۸۵ تا ۹۷%)[۲۷] .
اثر TFC جدید بر روی نتیجه تشخیصی
مطالعات متعددی بر روی اثر TFC تجدید نظر شده بر روی نتیجه تشخیصی خصوصا برای CMR گزارش می شود [۲۲,۲۸-۳۰]. به طور متفق القول، این مطالعات یک کاهش در شیوع معیارهای ماژور و مینور CMR را در TFC اصلاح شده در مقایسه با TFC اصلی نشان می دهد. این مطابق است با کاهش در حساسیت در بیشتر این مطالعات [۲۲-۲۹]. به طور قابل توجهی، اگرچه حساسیت کاهش یافته است، مقدارپیشگویی کننده مثبت (PPV) با TFC تجدید نظر شده افزایش یافته است، همان طور که به وسیله Femia و همکاران نشان داده شده است (افزایش PPV از ۲۳% در معیارهای اصلی تا ۵۵% در معیارهای تجدید نظرشده)[۳۰]. این احتمالا عمدتا به دلیل شامل شدن معیارهای کمی CMR است.Vermes و همکاران گزارش می کنند که ۹۷% از موارد با تغییرات مینور بر اساس کرایتریای اصلی CMR معیارهای تجدید نظر شده را پر نکردند [۲۹]. بعلاوه، حساسیت پایین CMR برای تشخیص ARVC در ضمیمه متنی که اخیرا منتشر شد و نشان میدهد که اختلالات الکتریکی بر تغییرات ساختاری شناسایی شده به وسیله CMR تقدم دارد، قابل فهم می باشد [۳۱-۳۳]. این تاکیدی بر مفهوم ارزیابی ARVC است که بررسی نباید منحصرا بر اساس تنها یک تست، بویژه CMR باشد.
| جدول ۱ معیارهای تجدید نظر شده۲۰۱۰ Task Force برای ARVC* |
| ۱٫تغییرات ساختاری و اختلالات کلی یا ناحیه ای عمکردی |
| ماژور
معیارهای اکوکاردیوگرافی دو بعدی آکینزی ناحیه ای RV،دیس کنیزی، یا آنوریسم و یکی از اندازه گیری های پایان دیاستولی زیر: PLAX RVOT ≥ ۳۲ mm (PLAX/BSA ≥ ۱۹ mm/m2)، یا PSAX RVOT ≥ ۳۶ mm (PSAX/BSA ≥ ۲۱ mm/m2) ، یا تغییرات کسر ناحیه ≤ ۳۳% |
| معیارهای CMR
آکینزی یا دیس کینزی یا انقباضات ناهماهنگ منطقه ای RV و یکی از یافته های زیر: (خانمها) ≥ ۱۰۰ mL/m2 یا (آقایان) RV EDV/BSA ≥ ۱۱۰ mL/m2 کسر تخلیه ای RV ≤۴۰% کرایتریای آنژیوگرافی RV آکینزی، دیس کنیزی، یا آنوریسم ناحیه ای RV |
| مینور
معیارهای اکوکاردیوگرافی دو بعدی آکینزی یا دیس کینزی یا انقباضات ناهماهنگ منطقه ای RV و یکی از اندازه گیری های پایان دیاستولی زیر: ا <19 mm/m2) تا <32 mm (PLAX/BSA ≥۱۶ تا PLAX RVOT ≥۲۹ یا <21 mm/m2) تا <36 mm (PSAX/BSA ≥۱۸ تا PSAX RVOT ≥۳۲ یا تغییرات کسر تخلیه ای > 33% ≤ ۴۰% |
| معیارهای CMR
آکینزی سطح RV یا دیس کینزی یا انقباضات ناهماهنگ ناحیه ای RV و یکی از موارد زیر: (خانمها) ۱۰۰ mL/m2 تا ≥۹۰ یا (آقایان) ۱۱۰ mL/m2تا RV EDV/BSA ≥۱۰۰
کسر تخلیه ای RV> 40 تا≥ ۴۵% |
| ۲٫ خصوصیات بافتی دیواره |
| ماژور
میوسیت های باقیمانده <60% به وسیله آنالیزهای مورفومتریک ( یا< 50% اگرتخمین زده شده)، با جایگزینی فیبروز در دیواره آزاد میوکاردRV در≥ ا نمونه با یا بدون جایگزینی بافت چربی در بیوپسی اندومیوکارد |
| مینور
میوسیت های باقیمانده ۶۰% تا ۷۵% به وسیله آنالیزمورفومتریک ( یا۵۰ تا ۶۵٪ اگرتخمین زده شده)، با جایگزینی فیبروز در دیواره آزاد میوکاردRV در≥ ا نمونه با یا بدون جایگزینی بافت چربی در بیوپسی اندومیوکارد |
| ۳٫ اختلالات رپلاریزاسیون |
| ماژور
موج T معکوس در لیدهای پره کوردیال راست (V1, V2, V3 ) یا بیشتر در افراد > 14 سال ( در نبود RBBB کامل QRS ≥ ۱۲۰ میلی ثانیه) |
| مینور
موج T معکوس در لیدهایV1 و V2 و V3 در افراد> 14 سال ( در نبود RBBB کامل یا در V4,V5 وV6) موج T معکوس در لیدهای,V3, V2 ,V 1و V4 در افراد > 14 سال در صورت وجود یک RBBB کامل
|
| جدول۱ کرایتریای بازبینی شده ۲۰۱۰ Task Force برای ARVC*(ادامه) |
| ۴٫اختلالات دپولاریزاسیون/هدایت |
| ماژور
موج اپسیلون(سیگنالهای تکرارپذیر با دامنه پایین بین پایان کمپلس QRS تا شروع موجT) در لیدهای پره کوردیال راست ( V1-V3) |
| مینور
پتانسیل تاخیری به وسیله SAECG در ≥۱ از ۳ پارامتر در نبود یک QRS≥ ۱۱۰ میلی ثانیه در ECG استاندارد -مدت QRS فیلتر شده (FQRS) ≥۱۱۴ میلی ثانیه – مدت QRSانتهایی<40میکرو ولت ≥ ۳۸ میلی ثانیه -root-mean-square ولتاژ ۴۰ میلی ثانیه انتهایی ≤۲۰میکرو ولت مدت فعالسازی انتهایی اندازه گیری شده از سمت پایانه موج S تا انتهای تمام انحناهای دپولاریزاسیون ( شامل ﯜ (Rدر V1،V2 یا V3 ≥۵۵ میلی ثانیه |
| ۵٫آریتمی ها |
| ماژور
VT پایدار یا ناپایدار از موفولوژی LBBB با محور فوقانی |
| مینور
VT پایدار یا ناپایدار از شکلRVOT، با مورفولوژی LBBB با محور تحتانی یا محور نامشخص بیش از ۵۰۰ ضربان نابجای بطنی در شبانه روز در هولتر مونیتورینگ |
| ۶٫ سابقه خانوادگی |
| ماژور
ARVC در اقوام درجه یک با کرایتریاهای Task Force ARVC تایید شده از طریق بررسی پاتولوژی دراتوپسی یا جراحی در اقوام درجه یک شناسایی جهش های بیماری زا که در بیماران تحت بررسی به عنوان مربوط و یا احتمالا مربوط به ARVC طبقه بندی می شوند |
| مینور
سابقه ARVC در اقوام درجه یک خانواده که تعیین اینکه آیا آن فرد خانواده کرایتریای Task Force را پر می کند ممکن نباشد. مرگ ناگهانی نابهنگام (<35 سال) به دلیل ARVC مشکوک در یک فرد درجه یک فامیل ARVC که با پاتولوژی یا به وسیله کرایتریای فعلی Task Force در افراد درجه دو فامیل تایید شده باشد. |
برگرفته از مرجع # ۲۱٫ اختصارات:
ARVC: Arrhythmogenic Right Ventricular، BSA: body surface area؛ CMR: cardiac magnetic resonance؛ ECG :electrocardiogram؛ EDV: end-diastolic volume؛ LBBB :left bundle branch block؛ PLAX: parasternal long axis؛ PSAX :parasternal short axis؛ RV: right ventricular؛ RVOT: right ventricular outflow tract؛ SAECG: signal-averaged electrocardiogram؛VT: ventricular tachycardia.
جدول ۲ پروتکل توصیه شده CMR برای ARVC
| رشته پالسی | سطح تصویربرداری | پارامترها | توضیحات |
| Double inversion recovery TSE/FSE
الف) آگزیال: با و بدون خنثی کردن چربی ب)محورکوتاه: بدون خنثی کردن چربی |
الف)آگزیال: تقریبا ۶-۸ تصویر با تمرکز روی بطن راست/چپ بدست می آید.
ب)محور کوتاه: تقریبا حدود ۶-۸تصویر با تمرکز روی بطن چپ بدست می آید. |
TR=2 برابرفواصلRR،TE= 5 میلی ثانیه. (حداقل کامل) (GE)،TE=30 میلی ثانیه (زیمنس)
ضخامت برش=۵ میلی متر، فاصله بین برش ها=۵ میلی متر ، و میدان دید(FOV) برابر ۲۸-۳۴ سانتی متر و ETL برابر ۱۶-۲۴ می باشد. |
این رشته پالسی تعیین خصوصیات بافتی دیواره آزاد RV را به بهترین شکل از شریان ریوی تا دیافراگم را فراهم می کند. خنثی کردن چربی اطمینان فرد گزارش کننده را در تشخیص انفیلتراسیون چربی RVبهبود می بخشد
|
| تصاویر متحرک SSFP خون روشن | آگزیال، چهار حفره و محور کوتاه نمای ۳ حفره RV (انتخابی) | حداقل TR/TE،angle flip=45- ۷۰درجه، ضخامت برش=۸ میلی متر . فاصله بین برش ها= ۲ میلی متر .FOV=36-40 سانتی متر ، ۱۶- ۲۰ نما در هر قطعه. ضریب تصویر برداری موازی معادل دومطلوب است | تصاویر آگزیال برای ارزیابی حرکت دیواره RV بهترین هستند. آنالیز کمی RV درتصاویر متحرک از نمای محوری کوتاه انجام می شود. |
گادولینیوم بر اساس پروتکل بنیادی تزریق می شود(معمولا ۰٫۱۵- ۰٫۲میلی مول برای ا کیلوگرم)
| T1 Scout | چهار حفره | رشته های پالسی T1 Scout یا زمانهای سنجش TIبرای سرکوب میوکارد نرمال به منظور پیدا کردن زمان صحیح وارونگی (T1) استفاده میشوند. | |
| تصاویر گادولینیوم تاخیری (توصیه بر استفاده از Phase
Sensitive Inversion Recovery ) |
آگزیال،محور کوتاه، چهار حفره و محور طولی عمودی | TR/TE بر اساس پیشنهاد کمپانی تولید کننده. ایجاد زاویه ۲۰-۲۵ درجه، ضخامت برش=۸ میلی متر ،فاصله بین برش=۲ میلی متر ،FOV=36-40 سانتی متر ، عدم تصویربرداری موازی. استفاده از phase sensitive
inversion recovery اگر در دسترس باشد (PSIR) |
PSIR بسیار قدرتمند و مستقل از زمان TI هست.بهترین برای تصویربرداری فیبروز است.enhancement اپیکارد LV در دیواره تحتانی جانبی در ARVC کلاسیک و فرم غالب چپ گزارش شده است. |
اختصارات:
ARVC :Arrhythmogenic Right Ventricular Cardiomyopathy؛ LV :left ventricle؛ FOV: field of view؛ FSE: fast spin echo؛ PSIR: phase sensitive inversion recovery؛ RV: right ventricle؛ SSFP :steady state free precessio؛ TE: echo time؛ TI :inversion time؛ TR repetition time؛ TSE: Turbo spin echo.
محدودیت های ارزیابی کمّی بطن راست: معیارهای task force بازبینی شده
وارد کردن معیارهای کمّی به عنوان یک جز CMR TFC سهم مهمی در ارزیابی های ARVCدارد، اگرچه برخی محدودیت ها باقی است. اولا، اگرچه مقادیر کمّی از اصلیت CMR TFC کاسته، تنوع قابل توجه برای RV بین خواننده ها ایجاد کرده است. در تجربه ما، دو خواننده پزشک، توافق کاملی ( در حدود ۵% از مقادیر رفرنس) تنها بعد از تعلیم نزدیک به ۱۰۰ مورد CMR داشتند [۳۴]. در تجربه بالینی، ما انتظار داریم که رسیدن به تکرار پذیری کمتر از ۱۰% برای پارامترهای RVدشوار باشد. حد مرزها برای معیارهای ARVC از مطالعه MESA مشتق شده و در مطالعه از تکنیک FGRE استفاده شده است، در حالی که اکثریت موارد مورد مطالعه در مطالعه ARVC تصاویر متحرک SSFP داشتند. حجمRV بدست آمده به وسیله SSFP حداقل ۱۰% بیشتر از موارد اندازه گیری شده با تکنیک FGRE می باشد [۳۹-۳۵]. تصاویر SSFP تمایز بالاتری بین خون و اندوکاردیوم در محدوده اندوکارد را فراهم می کنند، با کم ترین وابستگی به جریان خون[۳۵،۳۶،۴۰]. همچنین، TFC بازبینی شده از موارد MESA که میانگین سنی انها ۶۰ سال بود استفاده کرده است. موارد ARVC در مطالعهTask Force ۲۰-۳۰ سال جوان تر بودند. از آن زمان، Chahal وهمکاران تعیین کردند که در میان شرکت کننده های ۴۵ تا ۸۴ سال در MESA ، حجم پایان دیاستولیک RV 6.4 % در هر دهه کاهش یافته است[۳۴]. یک درصد بسیار مشابه نزدیک به ۴% کاهش در هر دهه توسط Maceira و همکاران با استفاده از تکنیک SSFP در افراد ۲۰ تا ۸۰ سال به دست آمد [۴۱]. تنظیم بر اساس ناحیه سطح بدن ،وابستگی حجم RV به سن را حذف نکرد. تصادفا، مسأله رشته پالسی و افراد مسن تر در MESA تقریبا با هم در تعادل هستند. به عنوان مثال، مقادیر حد مرز CMRبرای اندازه RV در ARVC(جدول ۱) شامل ≥۱۱۰ml/m2 (مرد) یا≥ ۱۰۰ ml/m2 (زن) برای کرایتریاهای ماژور هستند.این مقادیر با دقت زیاد با صدک ۹۵% ضریب اطمینان حجم RV برای افراد نرمال کمتر از ۶۰ سال تطابق دارند [۴۱]. بدین گونه، تا وقتی که مطالعات بعدی در دسترس باشند، ما احساس می کنیم که معیارهای فعلی RV در TFC بازبینی شده کاملا مناسب باقی می مانند. به عنوان یک نکته مهم، پیشرفت های بعدی برای بهبود قابلیت تکرارپذیری ارزیابی کمّی RV به وسیله CMR مورد نیاز هستند.در هنگام ارزیابی بیماران جوان تر، پزشک CMR باید به یاد داشته باشد که سایز RV در یک فرد ۲۰ ساله در مقایسه با یک بیمار ۴۰ ساله در حدود ۱۰% بزرگتر قابل انتظار است.
یافته های رایج در ARVC به وسیله CMR
بیشتر اطلاعات ما درباره اختلالات ساختاری در ARVC حاصل مطالعات در رابطه با بیمارانی با فنوتیپ غالب RV است(شکل۱)[۴۲-۴۴]. موارد غیرطبیعی RV در ARVC به طور کامل توضیح داده شده است (مرور شده در [۱۵]). علاوه برکاهش کلی در عملکرد RV و بزرگی RV، نقایص جزئی منطقه ای بیشتری به طور مختلف متغیر درمتون با واژه های متفاوت توضیح داده شده اند (شامل برآمدگی کانونی، میکروآنوریسم، اتساع ناحیه ای ، هیپوکینزی ناحیه ای، وغیره). در TFC فعلی، واژه “آکینزی” (عدم حرکت) و “دیس کینزی” (حرکت غیرطبیعی – به جای انقباض در سیستول ،قسمتی از میوکارد در طی سیستول به بیرون برآمده می شود) و “حرکت غیر متوازن” (حداکثر انقباض منطقه ای در بافتهای میوکارد مجاور در زمان های متفاوت رخ می دهد) برای تمام روش های تصویربرداری (CMR،اکوکاردیوگرافی و آنژیوگرافی) برای توصیف حرکت غیرطبیعی قسمتی از دیواره در ARVC به کار رفته است. میکروآنوریسم ها واضحا در TFC بازبینی شده برای CMR توضیح داده نشدند؛ استفاده بیش از حد از این یافته توسط اعضای Task Force، بعنوان علت اشتباه قضاوت توسط پزشکان CMR در نظر گرفته شده که منجر به تشخیص های مثبت کاذب شده اند. اگرچه، میکروآنوریسم ها به عنوان آکینزی یا دیس کینزی ناحیه ای در معیارهای بازبینی شده توصیف شده است.
محل حرکت غیرطبیعی ناحیه ای RV در TFC بازبینی شده بیان نشده است. در حال حاضر ما میدانیم که دیستال RV (moderator band به اپکس در نماهای محور طولی) تفاوت بسیاری در الگوی انقباض در افراد نرمال را نشان می دهند. از این رو در ARVC، ما تاکید بر اهمیت حرکت غیر طبیعی قسمتی از دیواره درناحیه زیر تریکوسپید می کنیم. یک مثال بسیار عالی از این، علامت اکاردیون است که یک “crinkling” منطقه ای از میوکارد است می باشد. (شکل۲) [۴۶،۴۵]. در واژگان TFC، نشانه اکاردیون به دلیل منطقه بسیار کوچک و محدود از میوکارد با انقباضات ناهماهنگ می باشد.
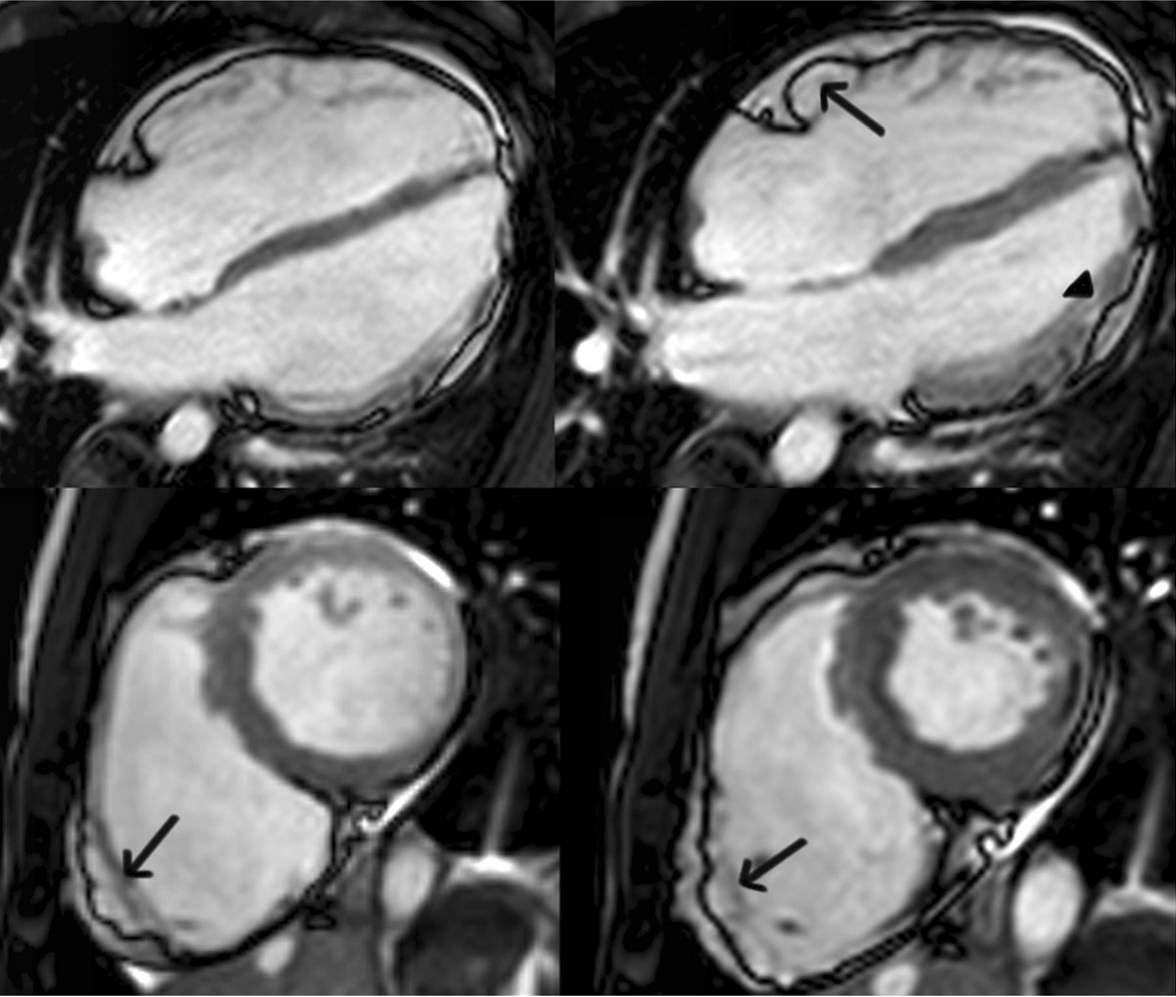
شکل ۱ نمای چهار حفره ای (بالا) و محور کوتاه (پایین) از تصاویرخون روشن در فرد ARVC با درگیری غالب اختلالات بطن راست. تصاویر پایان دیاستولی و پایان سیستولی هر دو بترتیب سمت چپ و راست نشان داده شده است. دیسکینزی ناحیه زیر تریکوسپید در نمای پایان دیاستولی چهار حفره ای (فلش)، و آنوریسم های دیواره آزاد بطن راست (بیرون زدگی هم سیستولی و هم دیاستولی )در نمای محور کوتاه(فلش ها) قابل ذکر است.
شکل ۲ انقباض غیرطبیعی در ناحیه زیر تریکوسپید.تصویر پایان دیاستول (چپ) و پایان سیستول(راست) “نشانه اکاردیون” را در یک حامل جهش ARVC نشان میدهد. انقباضات ناهماهنگ ناحیه ای در ناحیه زیرتریکوسپید حقیقتا یک الگوی کیفی از انقباض غیرطبیعی RV است.
|
طیف در حال تغییر ARVC: جابجایی مثلث دیسپلازی
از اولین گزارش در سال ۱۹۸۲، این گونه تصور می شد که نواحی غیرطبیعی در ARVC در قسمت ورودی،خروجی، و اپکس RV قرار دارند، که مجموعا تحت عنوان “مثلث د یسپلازی” شناخته میشدند [۱]. این مفهوم براساس یافته های آنژیوگرافی RV و اطلاعات اتوپسی در یک سری از ۲۴ بیمار مبتلا به ARVC بود. در سال های بعد، مطالعات توصیف تغییرات ساختاری در ARVCرا بر روی اختلالات این سه ناحیه متمرکزکردند [۴۷]. توجه به این نکته مهم است که مشاهدات درمراکز ثالثیه، بدون تست های پیشرفته ژنتیکی، و بدون TFC حساس انجام شده است. دهه گذشته شاهد تغییراتی در درک ما از درگیری ساختار ناحیه ای بودیم. در سری های اتوپسی، انفیلتراسیون غالب بافت چربی-فیبرو را در سطح اپیکارد نشان داده اند، و پیشنهاد می کنند که بیماری ازسطح اپیکارد شروع می شود و به اندوکارد پیشرفت می کند [۴۷]. در سال ۲۰۰۴،Marchlinski و همکاران اولین کسانی بودند که به درگیری ترجیحی ناحیه زیر تریکوسپید در ARVC اشاره کردند [۴۸]. این نتایج در چندین مطالعه با استفاده از CMR [50 ،۴۹] ،اکوکاردیوگرافی [۵۱]، و نقشه برداری ولتاژ الکتروآناتومیک اثبات شده است [۵۰،۵۲،۵۳]. اخیرا، در مطالعه Riele و همکاران یک سری از ۸۰ حامل جهش ARVC که تحت CMR و/یا نقشه کشی ولتاژ الکتروآناتومیک اندو و اپیکارد قرار گرفته بودند را فراهم کرد [۵۴]. ساختارهای غیرطبیعی در این گروه ترجیحا در ناحیه زیر تریکوسپید اپیکارد و قاعده دیواره آزاد RV قرار داشتند، در حالی که اپکس RV و اندوکاردیوم نسبتا از این قاعده مستثنی بودند. بعلاوه، نویسنده ها اغلب درگیری دیواره جانبی LV را بیشتر نسبت به اپکس RV گزارش کردند، خصوصا در مواردی با مراحل اولیه بیماری. این امر محققا منجر به “جابجایی” اپکس RV ازمثلث دیسپلازی شد [۵۴]. اگرچه درگیری ترجیحی ناحیه زیر تریکوسپید و دیواره جانبی LV قبلا در گزارشات جداگانه ARVC توضیح داده شده بود، تمرکز برعدم درگیری اپکس RV یک یافته جدید است. این بسیار مهم است، چرا که اپکس RV اغلب نازک است و ارزیابی آن مشکل می باشد و منجر به موارد زیادی از تشخیص نابجا می شود.
طیف در حال تغییر ARVC: درگیری بطن چپ
پیدایش تست های ژنتیکی و استفاده از TFC حساس به طور مشخصی درک ما را نسبت به طیف گسترده فنوتیپ ARVC افزایش داده، و آگاهی ما را از انواع فنوتیپ های غیرکلاسیک (شامل سمت چپ غالب و هر دو بطن) افزایش داده است. به عنوان نتیجه ، ما در حال حاضر می دانیم که برخی از موارد ARVCدرگیری غالب و اولیه LVرا دارند(شکل ۳) [۱۹, ۵۵-۵۷]. درگیری LV حتی در ۷۶% از موارد ARVCگزارش شده است، که اکثریت بیماری پیشرفته ای داشتند [۵۸]. بنابراین از این بیماری به طور فزاینده به عنوان “کاردیومیوپاتی های آریتموژنیک” یاد می شود. در ۲۰۱۰، Jainیک مطالعه با بررسی اختلال عملکرد ناحیه ای LV با استفاده از tagging CMR را هدایت کرد، و دریافت که پیک strain سیستولیک LV در موارد ARVC در مقایسه با گروه کنترل کمتر بوده است [۵۹]. Sen-Chowdhry و همکاران اخیرا اطلاعاتی را در حمایت از ارتباط ژنتیکی بین ARVC غالب چپ وARVC کلاسیک طرف راست منتشر کرده اند [۵۷]. در مطالعه آنها، یک سوم بیماران با فنوتیپ غالب طرف چپ یک جهش بیماری زا در ARVC وابسته به ژن دسموزومال داشتند.تفاوت های فنوتیپی در RV غالب ودرگیری LV حتی در یک خانواده به طور همزمان وجود داشتند.
درگیری LV در ARVC احتمالا به عنوان enhancement تاخیری گادولینیوم (LGE) تظاهر می کند که اغلب همراه با درگیری دیواره های تحتانی و جانبی بدون همراهی با حرکت غیرطبیعی دیواره ای می باشد [۶۰،۵۷،۵۵] LGE سپتوم در بیشتر از ۵۰% از موارد با ARVC غالب چپ وجود دارد، بر خلاف الگوی غالب راست که درگیری سپتوم در آن غیرمعمول است [۵۵]. بعلاوه، انفیلتراسیون چربی LV نشان داده شده که یک یافته شایع در ARVC است، که اغلب زیر اپیکارد جانبی LV را درگیر میکند و منجر به نازک شدن دیواره میوکارد می شود. (شکل ۴) [۵۴،۶۱] اطلاعات اولیه به وسیله Dalal و همکاران اخیرا نشان داد که چربی در دیواره جانبی برای حاملین جهش های ARVC بسیار اختصاصی می باشد [۴۵]. مطالعاتی در آینده برای تایید این اطلاعات، و برای درک بیشتر ما از اختلالات LV در ARVC مورد نیاز است.
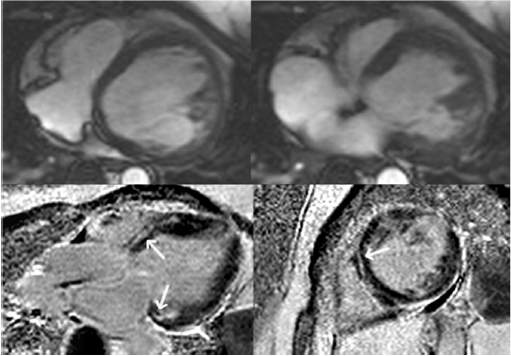
شکل ۳ محور طولی سطح افق(قسمت بالا) خون روشن و تصاویر enhancement تاخیری گادولینیوم (قسمت پایین) در موارد ARVC با بطن چپ غیرطبیعی غالب. به یک بطن چپ متسع در تصاویر خون روشن بطن چپ دقت کنید.enhancement تاخیری در الگوی میانی میوکارد در قاعده سپتوم و قاعده دیواره جانبی مشاهده می شود( فلش ها، قسمت پایین). |
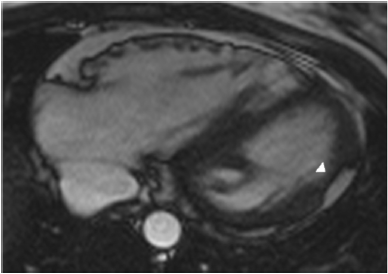
شکل ۴ تصویر خون روشن محور طولی سطح افق در یک بیمار با انفیلتراسیون چربی در دیوارهجانبی بطن چپ با کاهش ضخامت میوکارد(سر فلش) |
Enhancement تاخیری گادولینیوم در ارزیابی ARVC
LGE میوکارد یک تکنیک با اعتبار بالا برای ارزیابی فیبروز میوکارد است. معلوم شده که یکی از نشانه های پاتولوژیک ARVC جایگزینی بافت فیبروز- چربی در میوکارد است[۴۷]، توجه به این نکته مهم است که LGE رسما در TFC تشخیصی فعلی به ثبت نرسیده است. اگرچه Task Force وجود LGE دربسیاری از بیماران با ARVC را تشخیص نداده است، محدودیت های متعددی مانع از شامل شدن آن در معیارهای تشخیصی شد. اولا، شناسایی LGE در RV بشدت به وسیله نازک بودن دیواره RV مختل می شود. تفاوتهای زیاد در بین مراکز باعث محدودیت های LGE بر روی مطالعه ARVC در مراکز متعدد US شده است. در ARVC، کاهش ضخامت دیواره RV چشمگیر است[۴۲]، که این تکنیک را نسبت به LV کمتر قابل اطمینان می سازد. ثانیا، افتراق چربی از فیبروز به وسیله رشته های پالسی LGE چالش برانگیز است، چراکه تفسیر آن کاملا مربوط به تجربه پزشک CMR است. نهایتا اینکه، LV LGE غیراختصاصی است، و تشخیص افتراقی های گسترده ای دارد. LGE احتمالا در بسیاری از مقلد های ARVC قابل مشاهده است، مثل سارکوئیدوز[۶۲]، میوکاردیت [۶۳]،آمیلوئیدوز[۶۴]، و کاردیومیوپاتی های اتساعی (DCM) [65].
با وجود این محدودیت ها، LGE احتمالا برای ارزیابی ARVC بسیار مفید است (شکل ۵). RV LGEدر بیشتر از ۸۸% از بیماران دیده شده است [۶۶-۶۸]، در حالی که LV LGE در حداکثر۶۱% موارد گزارش شده است [۵۰،۶۹]. مهمتر از همه، قبل از آنکه LGE بتواند در TFC بعدی وارد شود، اطلاعات بیشتری در رابطه با اینکه الگوی خاصی از LGE که بتواند ARVC را از سایر کاردیومیوپاتی ها افتراق دهد نیاز است. همچنین، روش های پیشرفته برای تعیین فیبروز در RV با دیواره نازک مورد نیاز است. تا پدیدار شدن آن روش، استفاده از LGE در کاربردهای بالینی باید به عنوان یک تایید تشخیصی مدنظر باشد، نه تنها شاهد بیان بیماری ARVC . LGE CMR برای زمانی کهARVC به دلیل کاردیومیوپاتی دیگر مثلا سارکوئیدوز رد شده است بسیار مفید است. همچنین LGE احتمالا در اداره بیماران ARVC مفید است. Tandri و همکاران ارتباط بسیار خوبی از RV LGE را با هیستوپاتولوژی و آریتمی های بطنی قابل القا در مطالعات الکتروفیزیلوژیک نشان داده اند [۶۸]. همین طور، شناسایی LGE به وسیله CMR احتمالا راهنمایی برای مطالعات الکتروفیزیولوژیک و بیوپسی اندومیوکارد را فراهم می کند. اگرچه، توجه به این نکته مهم است که مطالعات اخیر در رابطه با تطابق LGE با اسکار الکتروآناتومی، حساسیت کمتر LGE را برای شناسایی نواحی با ولتاژ پایین نسبت به نقشه برداری اندوکاردیال در طی مطالعات الکتروفیزیولوژیک معلوم کرده اند [۷۰،۵۰].
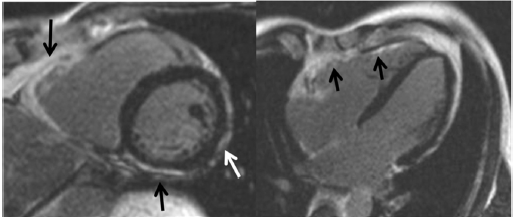
شکل ۵ enhancement تاخیری گادولینیوم بطن راست در ARVC.تصویر محور کوتاه(چپ) LGE را در RV و همچنین LV (فلش سیاه) نشان می دهد. دیواره جانبی LV کاهش ضخامت به دلیل جایگزینی چربی را نشان می دهد که با تصاویر T1-weighted تایید می گردد. نمای محور طولی (راست)LGE منتشر را با درگیری دیواره آزاد RV نشان می دهد. |
عدم تشخیص ARVC با استفاده از CMR
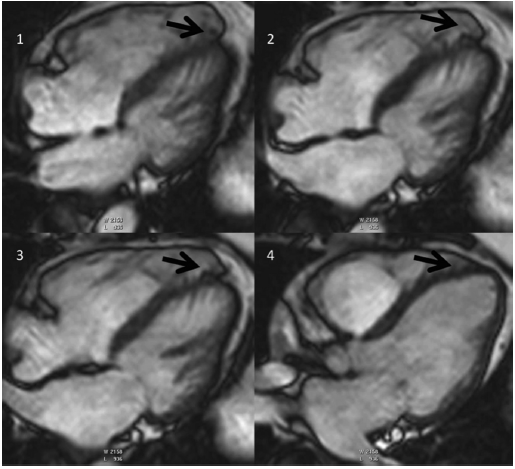
شکل ۶ اپکس پروانه ای به عنوان متغیری نرمال.توده در محور طولی افقی از قسمت تحتانی(تصویر ۱) تا قسمت بالا(تصویر۴)در یک مورد کنترل.توجه به ظاهر پروانه ای اپکس در نمای تحتانی (فلش در تصویر۱-۳). این ظاهر درنماهای فوقانی دیده نشده است (پانل ۴). |
تشخیص ناصحیح ARVC یک مشکل شناخته شده است. مطالعه قبلی نشان داده است که بیش از۷۰% از بیمارانی که از موسسات بیرونی به بیمارستان Johns Hopkins با تشخیص ARVC معرفی شدند دقیقا معیارهای تشخیصی TFC را نداشتند [۷۱]. در بسیاری از موارد، تفسیر غلط CMR دلیل تشخیص بیش از حد ARVC است [۷۱،۷۲]. اهمیت این نکته این است که، اگرچه CMR احتمالا استاندارد مرجعی برای ارزیابی مورفولوژی و عملکرد RV است، استفاده از CMR به تنهایی به عنوان “استاندارد طلایی” تشخیصی برای ARVC نمی باشد. ترجیحا، TFC استفاده از تست های تشخیصی مختلفی را توصیه می کند. زمانی که تنها حالت غیرطبیعی در بیماری با فرض به ARVC در CMRیافت می شود باید بسیار با احتیاط برخورد شود، همان طور که برای بیمار ARVC داشتن یک ECG و هولتر مانیتورینگ نرمال و یک CMR غیرطبیعی ناشایع است [۳۲]. درک مناسبی از موارد اختلالات رایج در CMR و الگوی های رایج بیماری در ARVC برای ارزیابی صحیح CMR بسیار ارزشمند است. مطالعات قبلی توجه بسیاری به جایگزینی چربی-فیبروز در میوکارد، نازکی دیواره،بزرگی RVOT، و اتساع و اختلال عملکرد RV در ARVC کرده اند [۴۲-۴۴]. همان طور که یکی از نشانه های پاتولوژیک ARVC شامل تجمع چربی در داخل میوکارد است، تصور می شد که حساسیت بالایی برای بیماری دارد. متاسفانه، گزارشات متعددی نشان دادند که گزارش چربی داخل میوکارد تکرار پذیر نبود حتی در میان گزارش کنندگان با تجربه، و این یک دلیل مهم تشخیص ناصحیح در ARVC را تشکیل می دهد [۴۴،۷۱،۷۳،۷۴]. بعلاوه، متغیرهای نرمال و سایر شرایط پاتولوژیک احتمالا ARVC را تقلید می کنند. متغیرهای نرمال مهم که قبلا برای ARVC اشتباه می شدند pectus excavatum [75]، بیرون زدگی اپیکو لترال در دیواره آزاد RV در محل اتصال moderator band [76]، و “اپکس بال پروانه ای”، که یک فرم نرمال آناتومیکال از اپکس های LV و RVاست و باعث می شود اپکس RV به نظر دیس کنیتیک آید [۷۷]. ما دریافتیم که نمای بال پروانه ای برای اپکس در نماهای محور طولی افقی و در سطوح تحتانی تر بسیار شایع تر است (شکل ۶).
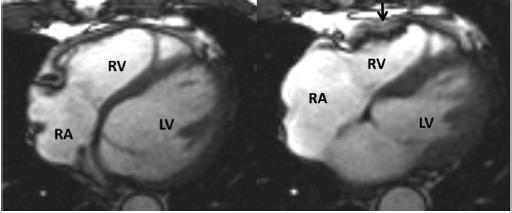
بعلاوه، یک باند برجسته از بافت پیوندی پریکاردیال که دیواره آزاد RV را به خلف استرنوم متصل می کند ممکن است بعنوان حرکت دیواره RV سوء تعبیرشود: این قسمت “tethered” از دیواره آزاد RV در این محل ساکن می ماند و احتمالا به عنوان دیس کنیزی RV سوء تعبیر می شود(شکل ۷). بعلاوه، اختلالات پاتولوژیک مثل میوکاردیت و سارکوئیدوزمی توانند ARVC را تقلید می کنند[۶۲،۷۸،۶۳]. تستهای بیشتری برای حذف این شرایط باید شدیدا مد نظر باشند، خصوصا در حضور اختلال عملکرد LV [79].
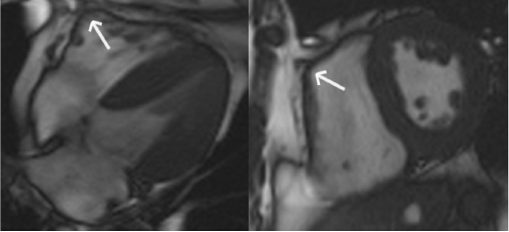
شکل ۷ عدم تشخیص ARVC-آگزیال و محور کوتاه تصاویر خون روشن در یک مورد کنترل. به ”tethering” قسمت میانی دیواره آزاد بطن راست به دیواره قدامی قفسه سینه(فلش ها) توجه کنید که با نمای دیس کنیتیک بطن راست تظاهر می یابد. |
بازبینی در ژنتیک ARVC
ARVC: یک بیماری دسموزومال
شروع با کشف اصلی پلاکوگلوبین در ۲۰۰۰بود [۸۰]، در دهه گذشته شاهد شناسایی جهش در پنج ژن کدگذاری دسموزوم قلبی بودیم[۸۱-۸۴]. در گزارشات اخیر، جهش های دسموزومال در بیشتر از ۶۰% از موارد ARVC یافت شده اند [۸،۱۳،۲۴،۸۵]. در میان بیماران امریکایی ARVC ، شایع ترین ژن درگیر plakophilin-2 [85]، سپس desmoglein-2، desmocollin-2 و desmoplakin است [۸۶]. شیوع این جهش ها در اروپا مشابه است [۸،۸۷]، اگرچه جهش های desmoplakin در انگلستان و ایتالیا شایع ترند [۱۰،۵۷] دسموزوم ها پروتئین هایی با ساختارهایی پیچیده هستند که پیوستگی نزدیک مکانیکال [۸۸] و الکتریکال [۸۹] با سلولهای همسایه را فراهم می کند. جدایی مکانیکال در ARVC همراه با مرگ سلولی و فیبروز ناحیه ای است، که باعث آریتمی های مونومورفیک که بطور تیپیک وابسته به ARVC می باشند می شود. بعلاوه، جدایی الکتریکی از بین محل های اتصال باعث تغییر وضعیت و اختلال عملکرد کانال سدیم می شود که می تواند منجر به تاخیر قابل توجه فعالسازی شود [۹۰،۹۱]، که این خود باعث افزایش تمایل به بلوک عملکردی و آریتمی می شود. فرضیه های بسیاری در مورد مکانیسم دقیق افزایش فنوتیپ آریتموژنیک در ARVC بواسطه این جهش ها وجود دارد، که در جای دیگری به طور گسترده مرور شده است [۲۰،۴۷] .لیست قسمت مربوط به ژن ها مروری کلی از ژن های وابسته به ARVC را نشان می دهد.
ژن های وابسته آریتموژنیک دیس پلازی/کاردیومیوپاتی بطن راست
ژن
دسموزومال
Desmocollin-2 (DSC2)
Desmoglein-2 (DSG2)
Desmoplakin (DSP)
Junctional Plakoglobin (JUP)
Plakophilin-2 (PKP2)
غیر دسموزومال
Desmin (DES)
Lamin A/C (LMNA)
Phospholamban (PLN)
Ryanodine Receptor (RYR2)
Transmembrane Protein 43 (TMEM43)
Titin (TTN)
ARVC:نقطه اشتراک با سایر کاردیومیوپاتی ها
علاوه بر جهش های دسموزومال، جهش ها در ژن های غیر دسموزمی در ARVC نیز شناسایی شده اند [۹۲-۹۸]. این ژن های غیر دسموزومی، در بین سایرین شامل دسمین، تیتین، لامین A/C، و فسفولامبان، که به طور شایع در بیمارانی با DCM جهش یافته اند می باشند [۹۹-۱۰۱]. اگرچه تمایز بینARVC و DCM جهت کاربرد بالینی و راهنمایی تشخیصی و هم درمانی کاربردهای مهمی دارد و یک همپوشانی قابل توجهی از این شرایط به طور فزاینده ای شناخته شده است [۱۰۲]. در قیاس با DCM ،بیماران با ARVC غالب چپ اغلب آریتمی های چشمگیر بطنی نامتناسب با اختلالات مورفولوژی و اختلال عملکرد سیستول LVرا دارند [۵۷]. بعلاوه، فرایندهای التهابی مانند میوکاردیت(ویروسی) ممکن است ARVC غالب طرف چپ را تقلید می کند [۱۰۳]. در میوکاردیت ها، تصاویر T2-weighted ممکن است ادم بافتی را شناسایی کنند که معمولا در ARVCنیست [۱۰۴]. بعلاوه تصاویر fast spin echo T1 weighted در دقایق اول پس از تزریق کنتراست احتمالا برای شناسایی احتقان میوکارد و التهاب عضلانی دال بر میوکاردیت نقش دارند [۱۰۴،۱۰۵]. در موارد مبهم، مطالعات تهاجمی مانند نقشه برداری الکتروآناتومیک و بیوپسی اندومیوکاردیال احتمالا تشخیص قطعی تر را امکان پذیر می سازند [۶۳].
اثر ژنتیک در اداره بالینی ARVC
با شناسایی علت جهش های ARVC، ادغام تست های ژنتیکی در کاربرد بالینی در حال افزایش است.در حال حاضر، کاربردهای اصلی این تست ها در تایید بیماران شاخص و غربالگری پیوسته خانواده ها است [۱۰۶]. عموما ARVC به عنوان یک ویژگی اتوزومال غالب با قدرت نفوذ ناکامل و بیان متغیر انتقال می یابد. مطالعه اخیر Coxو همکاران تایید کردند که خویشاوندان حامل جهش بدون علائم بالینی در مقایسه با خویشاوندانی از یک پروباند بدون یک جهش بیماری زا شش برابر بیشتر درمعرض خطر ایجاد ARVC هستند [۸]. اگرچه، مهم است که درک کنیم که در ۵۰-۷۰ % از حاملین جهش ها هرگز بیماری تظاهر نمیکند [۲۳،۱۰۷،۷]، و شدت بیماری بسیار متفاوت است، حتی در میان افراد یک خانواده [۱۱] یا افراد حامل همان جهش [۹]. بصورت متضاد، نتیجه یک تست منفی ژنتیک در یک فرد شاخص نه احتمال بیماری را رد می کند، و نه احتمال یک روند ژنتیک را در شخص یا فامیل رد می کند [۱۰۶،۱۰۸]. به علت پیچیدگی های وابسته به تفسیر نتیجه تست ژنتیک در ARVC، مشاوره ژنتیک اولیه و تست های ژنتیک بعدی قویا توصیه می گردند [۱۰۶،۱۰۹].
CMR در ارتباطات ژنوتیپ-فنوتیپ ARVC
در دهه گذشته، چندین ارتباط ژنوتیپ-فنوتیپ در ARVC پیشنهاد شده است، اما مطالعات در مقیاس بزرگ در حال تایید این مشاهدات هستند. اخیرا، بیماران با جهش های متعدد دسموزومال، مسیر بالینی شدیدتری از آریتمی های بطنی و نارسایی قلبی را نسبت به افرادی با یک جهش منفرد را نشان داده اند [۱۰،۸۶]. بعلاوه، افرادی با یک جهش در ژن فسفولامبان یا دسموپلاکین ( خصوصا در هنگام درگیری انتهای-C دسموپلاکین) تظاهربیماری هر دو بطن/ یا درگیری مشخص سمت چپ و شیوع بالاتری از نارسایی قلبی را دارند [۱۹،۹۸،۱۱۰]. درگیری LV در این بیماران اغلب به صورت LGE در دور تا دور LV ، الگوی میانه میوکارد با گسترش به طرف راست از سپتوم تظاهر می یابد [۱۱۱] یک مثال در شکل ۳ نشان داده شده است. این الگوی ARVC غالب چپ نباید با درگیری طرف چپی که در مراحل پیشرفته درگیری غالب طرف راست هست اشتباه شود. این موارد درگیری غالب سمت راست (اغلب حاملین جهش پلاکوفیلین-۲) به طور شایعی بیمای کانونی LV را با درگیری دیواره LV همراه با اختلال عملکرد خفیف یا متوسط LV را دارند [۱۱۱]. در مطالعاتی با مقیاس بزرگ ناشی از ثبت های بین المللی برای حل بیشتر وابستگی های ژنوتیپ-فنوتیپ در ARVC مورد نیاز هستند.
بازبینی در درمان ARVC
درمان ARVC در جهت کاهش علائم، تاخیر در پیشرفت بیماری، و جلوگیری از SCD است. به دلیل فقدان مطالعاتrandomized trial جهت مقایسه گزینه های درمانی ARVC ، توصیه های درمانی ARVC کاملا بر اساس قضاوت های بالینی و نتایج مطالعات گذشته نگر بر اساسregistry است. درمان های اصلی شامل اقدامات محافظه کارانه (محدودیت ورزش)، بلوک کننده بتا و عوامل ضد آریتمی، تعبیه دفیبریلاتور-مبدل قلبی قابل کاشت (ICD)، و ریشه کنی آریتمی های بطنی با استفاده از امواج رادیوفرکوینسی است. شواهد برای نقش بالقوه ورزش در بیان ARVC و پیشرفت بیماری در حال افزایش است.بسیاری از بیماران ARVC معمولا زیاد ورزش می کنند و آنها که در رقابت های ورزشی شرکت می کنند ۵ برابر بیشتر در معرض مرگ های ناشی از آریتمی نسبت به افراد غیر ورزشکارند [۱۱۲]. اخیرا، James یک مطالعه بر روی نقش ورزش در گسترش ARVC را هدایت کرده،که نشان داده است که ورزش مقاومتی و ورزش مکرر ریسک آریتمی ها و نارسایی قلبی در حاملین جهش ARVC را افزایش می دهد [۱۱۳]. این قسمت مهم اطلاعات، اهمیت محدودیت ورزش در بیماران ARVC و کسانی که در معرض گسترش ریسک بیماری هستند را مشخص می کند. وقتی که تشخیص ARVC برای یک بیمار گذاشته شد، مهم ترین تصمیمی که باید گرفته شود کاشت یک ICD برای جلوگیری از SCD است.
در حال حاضر استاندارد مراقبت برای افرادی با سابقه ARVC با آریتمی بطنی قبلی پایدار تحت تعبیه کردن یک ICD است [۱۱۴،۱۱۵]. مطالعات نشان دادند که این بیماران شیوع بالای از میزان تخلیه مناسب ICD به میزان بالای ۷۰% در طی میانگین پیگیری ۳-۵ ساله را دارند [۱۱۵،۱۱۶]. متاسفانه، راهنماها برای کاشت ICD در بین مواردی بدون آریتمی بطنی قبلی گیج کننده هستند. مطالعات اخیرنقش مهمی برای CMR درطیقه بندی ریسک این بیماران نشان می دهد [۳۲،۱۱۷،۱۱۸]. در مطالعه آنها، Deac و همکاران نقش CMR غیرطبیعی را در حوادث آریتمیک به عنوان یک فاکتور پیشگویی کننده مستقل نشان دادند [۱۱۸]. همچنین، CMR TFC بازبینی شده ارزش پیشگویی کننده منفی بالایی برای وقوع آریتمی در ARVC را نشان داده است [۳۲]. کنترل آریتمی در ARVC اغلب به وسیله درمان های دارویی به دست می آید. بتابلوکرها و داروهای آنتی آریتمیک کلاس III (سوتالول،آمیودارون) جهت کاهش میزان آریتمی و احتمال تخلیه ICD موفق نشان داده شده اند [۱۱۹،۱۲۰]. بعلاوه، ریشه کنی مکرر رادیویی (ablation radiofreqency) برای آریتمی بطنی در ARVC درسال های گذشته با محبوبیت بسیاری مواجه شده است. اگرچه نتایج ریشه کنی اندومیوکارد متوسط بوده است [۱۲۱]، کنترل خوب آریتمی (البته نه درمان کامل) با استفاده از ریشه کنی اپیکارد به دست آمده است [۱۵،۱۲۲،۱۲۴]. این قابل فهم است،که محل اولیه سوبسترای غیر نرمال در ARVC در (زیر) اپیکارد قرار دارد. CMRبا LGE در برنامه ریزی این روش ها، به وسیله فراهم آوردن اطلاعات در حضور و توزیع اسکاربطنی، احتمالا بسیار مفید است [۱۲۵].
مسیر آینده
ارزیابی CMR در ARVC یک هدف در حال تغییر است. رشته پالسهای جدید CMR مثل نقشه برداری T1 با رزولوشن بالا ابزارهایی امیدبخش برای تشخیص زودرس تغییرات نهفته در RV هستند. بعلاوه، کمی سازی حرکات غیرطبیعی ناحیه ای دیواره RV و ارزیابی عدم هماهنگی بین بطنی و داخل بطنی احتمالا ابزارهای جدیدی برای تشخیص زودرس ARVC را فراهم می کنند. عصر ژنتیک امکان استفاده از تستهای ژنتیکی ARVC با استفاده از پانل های جامع کاردیومیوپاتی و تمام رشته های پالسی، که احتمالا اثری مشخص در دانش ما از پایه ژنتیک ARVC و همپوشانی با سایر کاردیومیوپاتی ها را دارد، فراهم می کند. بعلاوه، مطالعات ارتباط ژنوتیپ-فنوتیپ احتمالا تحقیق ما را برای ژنتیک و تعدیل کننده های محیطی در این بیماری هدایت می کند. در نهایت، پژوهش پایه ما در آزمایشگاه و مدل های حیوانی تاثیر مهمی بر دانش ما از پاتوفیزیولوژی ARVC داشته است. نتایج این مطالعات مسیر را برای سوبسترای غیرطبیعی در ARVC فراهم می کند، که امکان پیشگیری قطعی از ظهور بیماری بالینی و/یا پیشرفت آن را فراهم می کند.
نتیجه گیری
ARVC بیماری نادری است اما علت مهمی از SCD در افراد جوان و در ورزشکاران است. بیماری به صورت ویژگی اتوزومال غالب با نفوذ ناکامل و بیان متغیر به ارث می رسد. به علت ریسک ذاتی آریتمی های بالقوه کشنده، تشخیص صحیح و زودرس ARVC لازم است. این بسیار مهم است، چرا که با ظهور تست های ژنتیکی، اشخاص در معرض خطر به سرعت در حال افزایش اند. تشخیص بالینی ARVC به وسیله مجموعه پیچیده ای از کرایتریاهای تشخیصی که در سال ۱۹۹۴ منتشر و در سال ۲۰۱۰ بازبینی شد برای افزایش حساسیت تشخیص زودرس بیماری آسان گردیده است . به عنوان یک روش غیر تهاجمی استاندارد طلایی برای ارزیابی RV، CMR نقش بسیار مهمی در بررسی بالینی ARVC دارد. مطالعات اخیر نشان دادند که درگیری RV در ARVC اغلب با اختلال حرکتی ناحیه ای یا اختلال عملکرد گلوبال تظاهر می یابد، اگرچه درگیری LV اغلب به صورت LGE و/یا انفیلتراسیون چربی بدون همراهی همزمان اختلال حرکت دیواره مشاهده می شود. ARVC ترجیحا باعث درگیری قاعده RV و قسمت جانبی LV می شود، در حالی که اپکس RV را درگیر نمی کند. هنگامی که تشخیص ARVC گذارده شود، مهمترین تصمیم در اداره بیمار این است که آیا ICDبرای جلوگیری از SCD گذارده شود یا نه. مطالعات آینده جهت اشکار سازی پاتوفیزیولوژی بیماری و فراهم کردن بینشی درباره ارتباط ژنوتیپ-فنوتیپ در ARVC مورد نیاز است.
اختصارات
| کاردیومیوپاتی آریتموژنیک بطن راست | Arrhythmogenic right ventricular cardiomyopathy | ARVC |
| ام آر آی قلبی عروقی | Cardiovascular
magnetic resonance |
CMR |
| کاردیومیوپاتی اتساعی | Dilated cardiomyopathy | DCM |
| نوار قلب | Electrocardiogram | ECG |
| Fast gradient echo | Fast gradient echo | FGRE |
| دفیبریلاتور های قلبی قابل کاشت | Implantable cardioverter-defibrillator | ICD |
| جذب تاخیری گادولینیوم | Late
Gadolinium enhancement |
LGE |
| بطن چپ | Left ventricle | LV |
| مطالعات چند نژادی آترواسکلروز | Multi-ethnic study of
atherosclerosis |
MESA |
| مقدار پیشگویی کننده مثبت | Positive predictive value | PPV |
| بطن راست | Right ventricle | RV |
| مرگ ناگهانی قلبی | Sudden
cardiac death |
SCD |
| Steady state free precession | Steady state free precession | SSFP |
| Task Force Criteria | Task Force Criteria | TFC |
|
Translators: ۱٫ Dr.Zahra Alizadeh Sani Rajaie cardiovascular Medical &Research center,Iran University of Medical Science (مرکز تحقیقات قلب و عروق رجایی،دانشگاه علوم پزشکی دانشگاه ایران) ۲٫Pouya Nezafati Mashhad university of Medical Science (دانشگاه علوم پزشکی مشهد) ۳٫Mahya Masoomi Mashhad university of Medical Science (دانشگاه علوم پزشکی مشهد) ۴٫Bita Zargaran Research Committee, faculty of medicine, Islamic Azad University, Mashhad branch, Mashhad, Iran ۵٫Mohaddeseh Behjati Rajaie cardiovascular Medical &Research center,Iran University of Medical Science (کمیته تحقیقات پزشکی دانشکده پزشکی دانشگاه آزاد مشهد) Reviewer: Dr.Zahra Alizadeh Sani Rajaie cardiovascular Medical &Research center,Iran University of Medical Science (مرکز تحقیقات قلب و عروق رجایی،دانشگاه علوم پزشکی دانشگاه ایران) Reza Nezafat
|







سلام و خسته نباشید بابت انتشار این مطلب، من میخواستم مشاوره بگیرم در رابطه با این بیماری و درمان آن، چون بیشتر مطالب تخصصی بود و من فقط مقدار کمی مطالب جمع اوری کردم و اینکه آیا درمان قطعی برای این بیماری وجود داره؟؟؟ منتظر نظر شما هستم اگه میشه به من ایمیل بزنید