Neuroimaging in Dementia
معرفی دمانس و انواع آن:
دمانس یک بیماری مشخص و بخصوص نیست.یک اصطلاح توصیفی از مجموعه علایم و نشانه های است که اختلالات تاثیر گذار بر مغز ایجاد میکند.افراد مبتلا عملکرد فکری_ عقلی مختل شده دارند که در روابط شخصی یا فعالیت های عادی روزانه مشکل ایجاد میکند،آنان همچنین توانایی خود را برای حل مسائل و مشکلات و کنترل احساسات و هیجانات از دست میدهند و تغییر شخصیت و مشکلات رفتاری چون تحریک پذیری و عصبانیت ،توهم و یا هذیان گویی را نشان میدهند.با این که از دست دادن حافظه یکی از علائم دمانس است اما این موضوع به تنهایی دلیل بر دمانس نیست…پزشکان در صورتی که دو یا چند عملکرد مغز مانند حافظه،توانایی تکلم،ادراک یا توانایی های ادراکی مانند قدرت قضاوت بدون از دست دادن هوشیاری بطور معنی دار و برجسته ای دچار اختلال شود ،آنرا دمانس یا زوال عقلی تشخیص می دهند.
انواع دمانس:
کورتیکال یا قشری(ضعف حافظه و مهارت های تکلم و تفکر و رفتارهای اجتماعی)
ساب کورتیکال(علاوه بر حافظه،تغییرات احساسات و حرکت)
پیشرونده و تهاجمی(درگیر ی در تمام مغز)
در این بحث ما به بررسی نقش تصویربرداری در چند مورد شایع دمانس یعنی آلزایمر،دمانس عروقی،دمانس (lewy body) ،و frontotemporal می پردازیم
آلزایمر: این بیماری یکی از علل شایع زوال مغز در افراد مسن است، یک پروسه پیشرونده تخریب سیستم عصبی همراه با اختلال در عملکرد نرونی و نابودی تدریجی ادراک و عملکرد و رفتار افراد است.انباشت یک نوع پروتئین بنام آمیلویید بتا(amyloid beta) و نیز اختلال در تنظیم فسفاته شدن پروتئین tau و انباشت درون سلولی تانگل های نروفیبریل و انواع سمی و محلول پروتئینtau علت اصلی این بیماری است
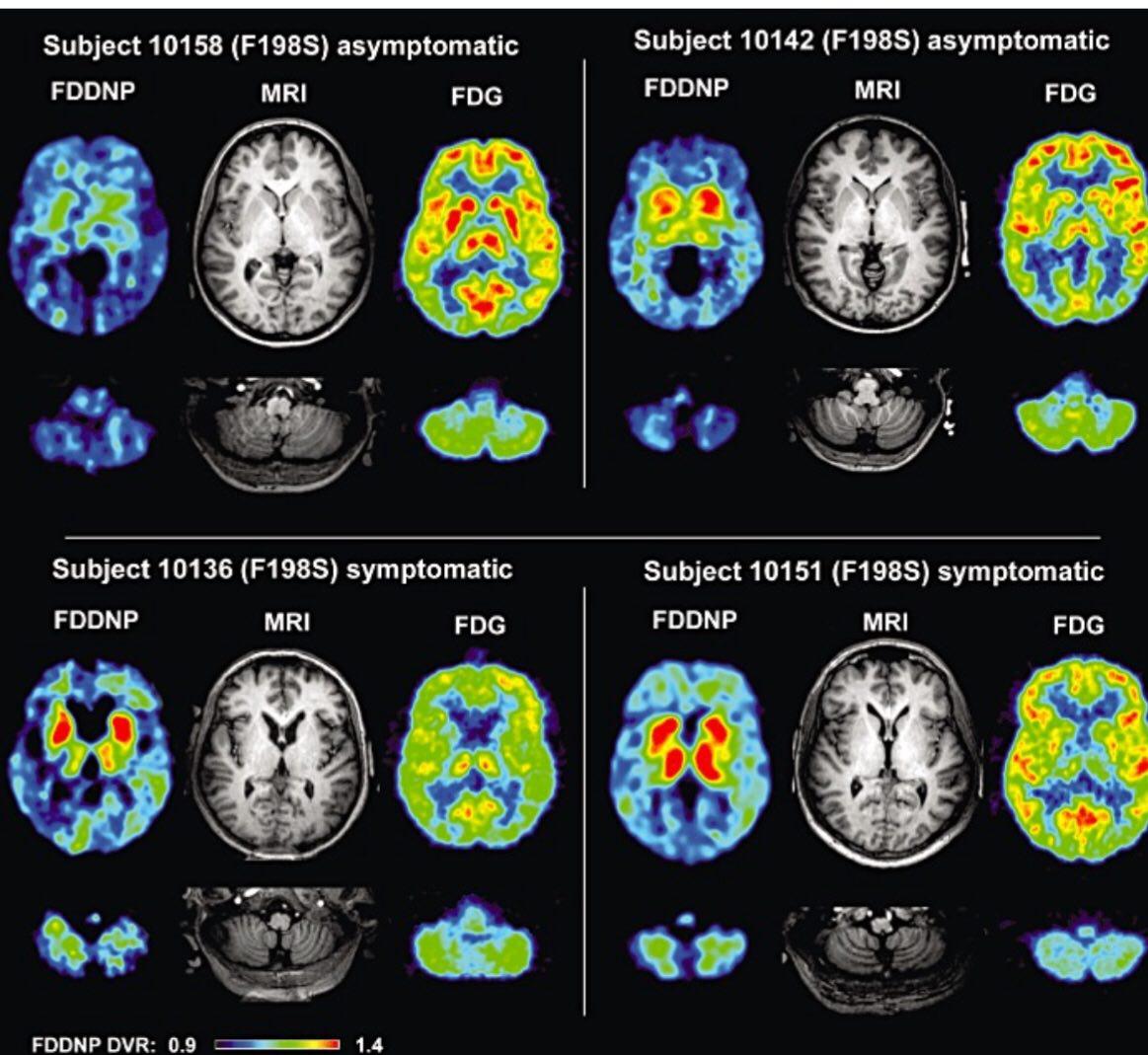
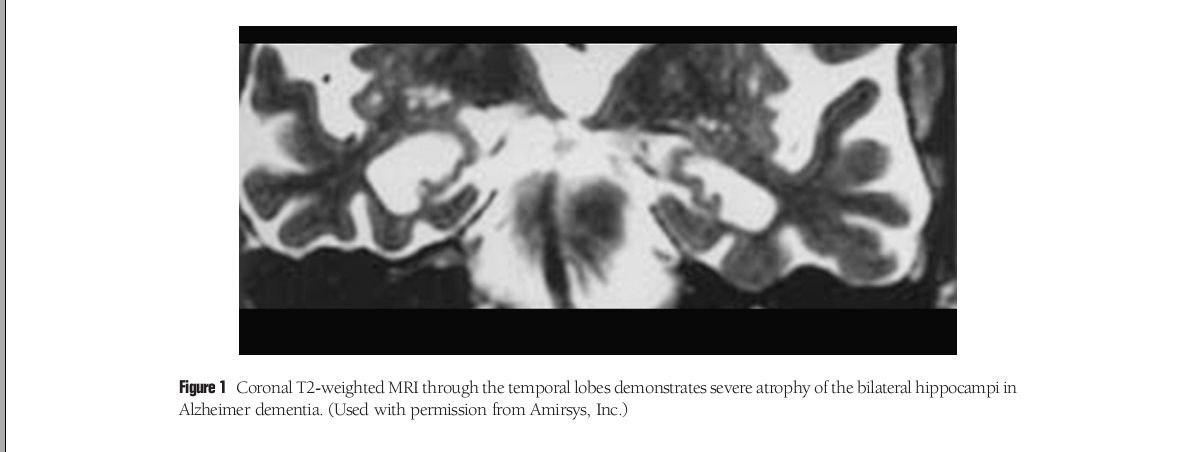
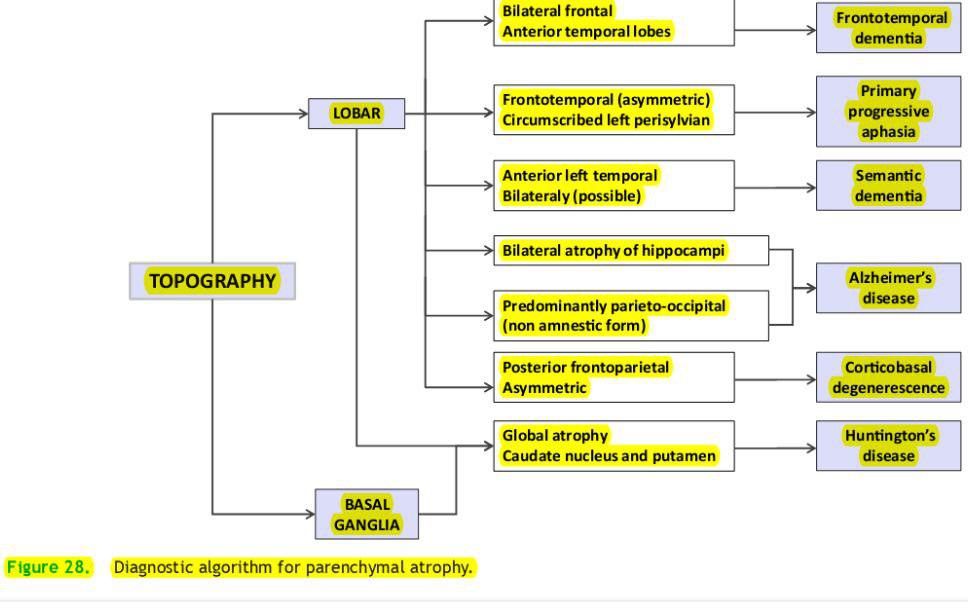
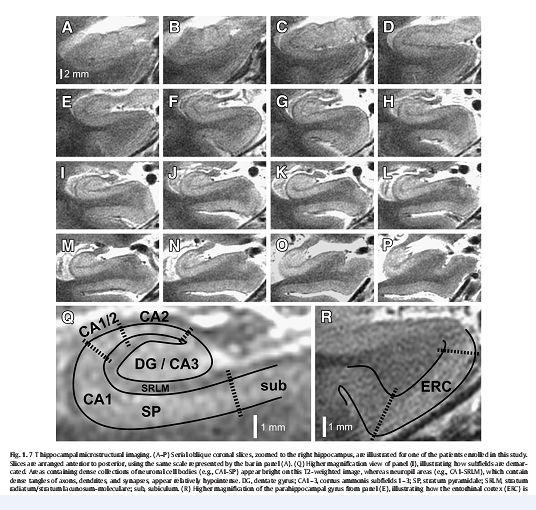
پیشرفت آتروفی به طور مشخص از لوب تمپورال میانی و مقدار غیر عادی پروتئین tau به عنوان اهداف تصویربرداری بشمار میروند.یک الگوی زوال از درون قشر مغز به بیرون و آتروفی هایپوکامپ به عنوان ریسک فاکتور برای کاهش قوه ادراکی و دمانس است و نیز علامت توسعه یک تخریب مزمن ادراکی(MCI) به آلزایمر می باشد.ارزیابی هایپوکامپ به عنوان پرکاربردترین مارکر ساختاری و آناتومیکال که براحتی به وسیله یک تصویر کرونال قابل بررسی است(با حساسیت و ویژگی بترتیب ۸۰% و۸۵% )
بهرهگیری از میدان های قوی ۷ تسلا می تواند اطلاعات ارزشمند درباره ساختار ماکروسکپی در هایپوکامپ و بازال گانگلیا در مقایسه با میدان های ضعیفتر (۳ تسلا) بدهد، بررسی مرگ نرونی به عنوان شاهد واقعی و نیز نقص انتقال عصبی که خیلی قبل تر در قسمت هایی از نرون رخ داده که الگوی آکسونی کورتکس میانی را دریافت کرده اند.تفاوت چشمگیر در ضخامت این قسمت از نرونها در مقایسه با تنه نرون ها در بیمار مبتلا را شاهد هستیم که جهت تمایز یک فرد سالم از فرد مبتلا بسیار حساس و کمک کننده می باشد
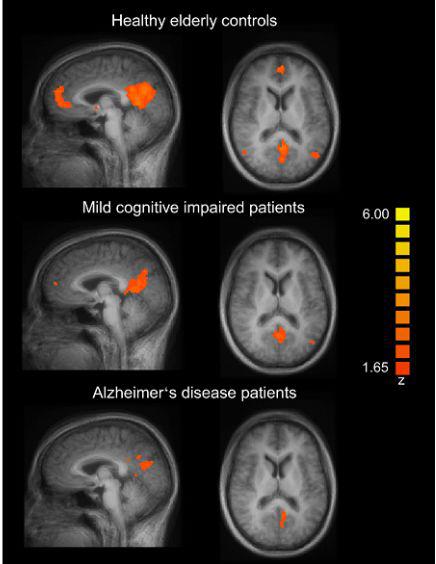
تغییرات فانکشنال و بررسی با BOLD f MRI: مطالعات در حوزه آلزایمر معمولا با ارزیابی عملکرد تمام مغز در زمان اعمال محرکها(task) مربوط به حافظه و نیز بررسی وجود یا عدم وجود ارتباط بین نواحی مختلف مغز در جریان بررسی در حالت rest یا عدم اعمال محرک انجام میشود.یافته ها در مطالعه با اعمال محرک مربوط به حافظه در هر دو بیمار مبتلا به آلزایمر و نوع مزمن(mild CI) شامل تخریب عملکردی متفاوت در هایپوکامپ و عدم فعالیت ناحیه ای مرتبط با حافظه در این بیماران است،بلعکس در حالت عدم اعمال محرک به توصیف همگام سازی زمانی بین نواحی مختلف مغز و به طور شایع در default mode network( posterior cingulate,percuneus, medial prefrontal,bilateral parietal cortex) می پردازیم,
در یک فرد سالم ناحیه DMN در طول زمان عدم اعمال محرک، فعال است ولی در زمان انجام پردازش ادراکی در خاموشی فرو میرود و در یک فرد مبتلا به آلزایمر درجات ضعیفتر از خاموشی در طی زمان فعالیت ناحیهDMN را شاهد هستیم.این یافته ها کاهش ارتباط بین نواحی DMN را آشکار میکند خصوصا در بیماران مشکوک به آلزایمر که دارای اسکن مثبت با PET هستند و این بیماران در واقع در معرض خطر ارتقای نوع مزمن(MCI) به آلزایمر در چند سال آینده هستند
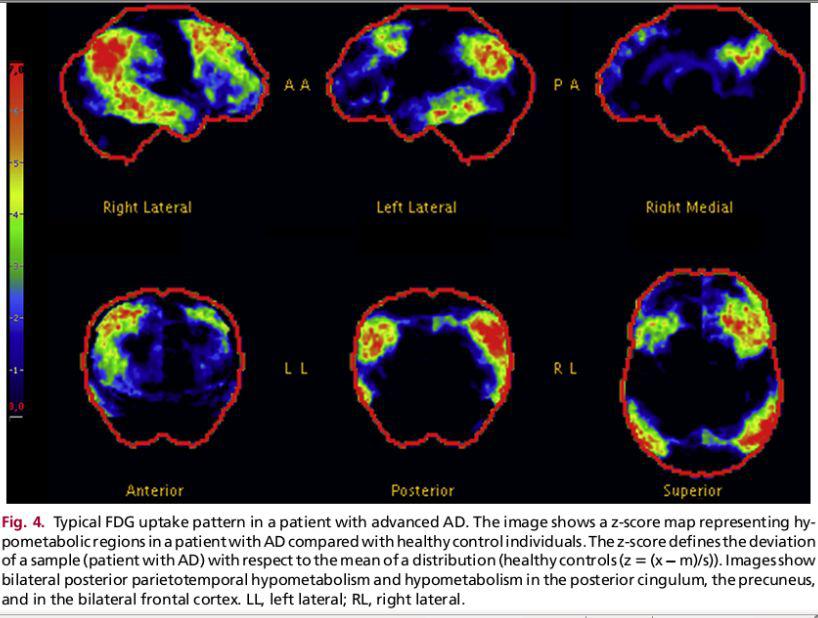
تصویربرداری بوسیله مونیترینگ متابولیسم گلوکز و ردیابی آن در بدن و مغز یک روش ارزیابی بیماری آلزایمر است که در آن شاهد یک کاهش تدریجی و پیشرونده در متابولیسم گلوکز هستیم که بعنوان یک روش در تشخیص در مراحل قبل از وارد شدن به فاز تخریب نرونی و فاز حاد بسیار کارآمد است.تشخیص نقص در ناحیه تمپوروپریتال خلفی ،سینگولیت خلفی،فرونتال تحتانی در اسکن PET مربوط به آلزایمر که از تخریب نرونی حکایت دارد مشاهده میشود.این روش قادر است پیش بینی کند که کدامیک از افراد تحت مطالعه یک توسعه تخریب نرونی به سمت MCI و نیز کدامیک از MCI بسمت آلزایمر شیفت می شوند.بیومارکر حساس در این روش در واقع کاهش متابولیسم در لوب تمپورال در افراد سالمی است که به سمت MCI شیفت دارند.بیومارکر اولیه و حساس برای شیفت به فاز بیماری آلزایمر نیز با کاهش ناحیهای متابولیسم در کورتکس سینگولیت خلفی مشاهده می شود.
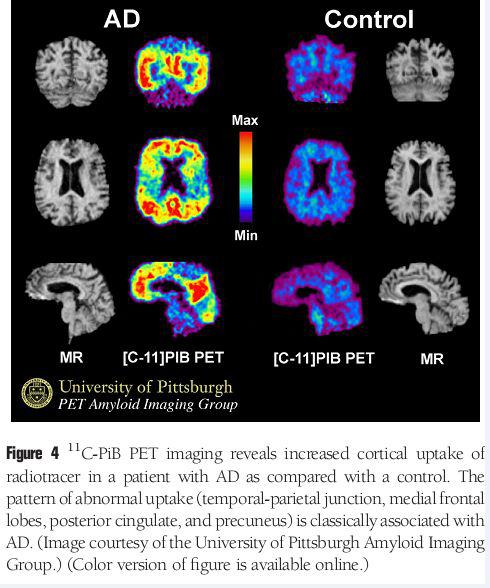
پلاکهای آمیلویید و تانگل های نروفیبریل و پروتئینTau به عنوان مارکر نوروپاتولوژیک در بیماری آلزایمر هستند که قبل از بروز علایم بالینی و توسعه به سمت آلزایمر در مغز انباشت می شوند .کشف پروتئین آمیلویید در مغز انسان به وسیله PET و لیگاند های خاص صورت میگیرد ولی قید و شرط خاصی ندارد و آمار بالایی از موارد مثبت کاذب در بیماران سالم دارد.مثلا یک نوع لیگاند خاص بنام C11_PIB در تمایز فرد سالم از مبتلا کاربرد ندارد و تنها جهت تشخیص بیمار مبتلا به آلزایمر از دیگر پروسه های تخریب نرونی کاربرد دارد.در یک مثال عملی: بیمار مبتلا به آلزایمر دارای جذب بالایی از لیگاند نسبت به بیماران پارکینگسون و دمانس فرونتوتمپورال هستند
لیگاند F18 نتنها با پلاکهای آمیلویید بلکه اغلب با پروتئین tau در تانگل های نروفیبریل باند می شود…در این مورد شاهد افزایش جذب این لیگاند در هر دو بیمار مبتلا به آلزایمر و نوع مزمن(MCI )در مقایسه با افراد سالم هستیم .شاهدتمایز ۱۰۰% بین افراد سالم و مبتلا به آلزایمر و نیز تمایز ۹۵% بین افراد سالم با MCI هستیم.
پرفیوژن: روشهای تصویربرداری پرفیوژن پیشرفته و بهرهگیری از آنها باعث ارتقای نگاه کارشناسان به بیماریهای تخریب عصبی از جمله آلزایمر شده است.نقص و اختلال در حوزه پرفیوژن قبل از ظهور علایم کلینیکی و ارتباط آن با کاهش قوای ادراکی در بیماران با تشخیص آلزایمر ثابت شده است.کشف نواحی با نقص پرفیوژنی می تواند در تشخیص آلزایمر از سایر پروسه های دمانس مغزی موثر باشد.به طوری که افزایش پرفیوژن بصورت گذرا می تواند در مراحل اولیه بروز بیماری رخ دهد که ممکن است به دلیل عملکرد جبرانی مغز باشد که هنگام اختلال در عملکرد یک ناحیه رخ میدهد.بهرحال نکته مهم این است که تغییرات چشمگیر در جزییات الگوهای پرفیوژن در مراحل اولیه بیماری وجود دارد که باید مورد توجه قرار گیرد.همین تغییرات است که باعث ایجاد محدودیت در استفاده از این روشها برای تشخیص در مراحل اولیه شده است! مطالعات بلند مدت و ثبت تغییرات پرفیوژن جهت درک عمیق تر از نحوه پیشرفت بیماری می تواند کمک کننده باشد.
روش عمده بررسیهای پرفیوژنی در ام آر آی شامل DSC و ASL و نیز روش DCE می باشد. روش DSC که روش مرسوم تر در مطالعات بیماری آلزایمر است و نیاز به تزریق ماده کنتراست زا دارد. این روش امکان محاسبه دو پارامتر مهم حجم خون مغزی(CBV) و جریان خون مغزی(CBF) که اطلاعات مشابه PET را می دهند،وجود دارد.طبق مطالعات یک کاهش ۱۷% در میزان حجم خون مغزی ناحیهای در لوب تمپوروپریتال دو طرف در مقایسه با cerebral مشاهده میشود و این در حالی است که در افراد سالم تحت کنترل هیچ کاهش پرفیوژن در مقایسه با بیماران آلزایمر ی مشاهده نشده است. افزایش پرفیوژن در ناحیه فرونتوبازال در مراحل اولیه آلزایمر در بیماران مبتلا به نوع MCI وجود دارد که همراه یک توسعه به لوب فرونتال است که گواه بر جبران سیستم عصبی بدلیل نقص پرفیوژنی ناحیه مجاور است
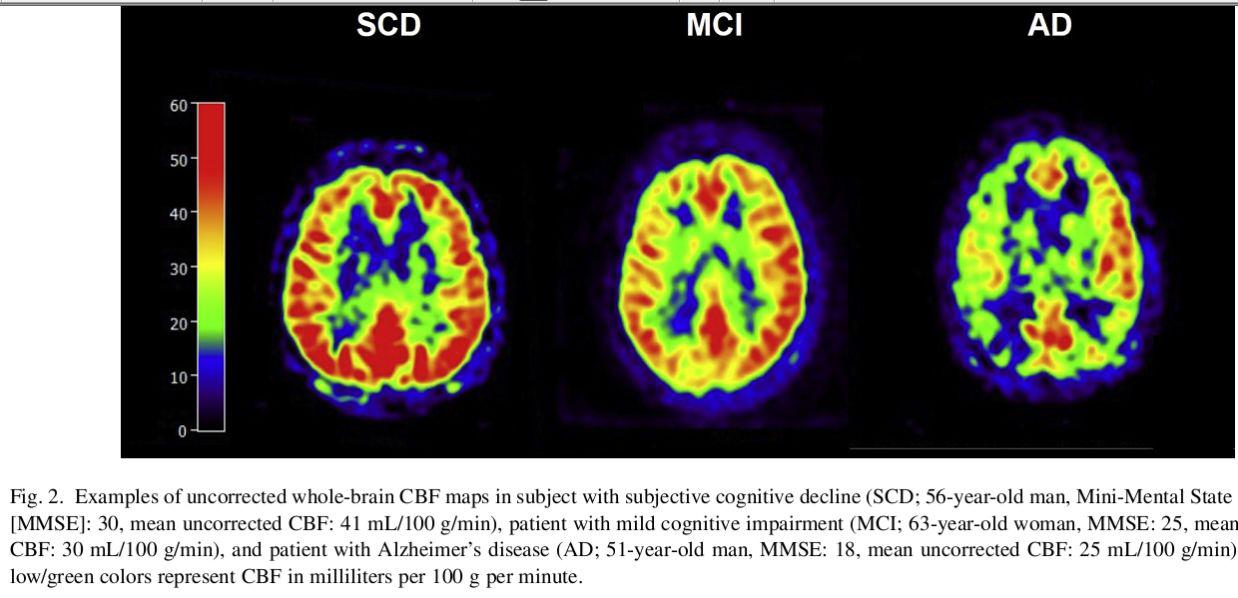
روش قابل اطمینان دیگر در مطالعات پرفیوژنیASL است که بدلیل کنتراست ذاتی و عدم تزریق ماده کنتراست بسیار مورد توجه قرار گرفته است و می تواند نتایج مشابهPET را ارائه بدهد.از الگوهای کاهشCBF برای تمایز آلزایمر از دمانس فرونتوتمپورال به وسیله این روش میتوان بهره برد،همچنین افزایش CBF در( right anterior (cingulate gyrus در بیماران مبتلا به آلزایمر در مقایسه با افراد سالم و نیز افزایش پرفیوژن در هایپوکامپ چپ و (right amygdala) و نواحی بازال گانگلیا نیز برای تشخیص نوع مزمن از افراد سالم کمک کننده است.
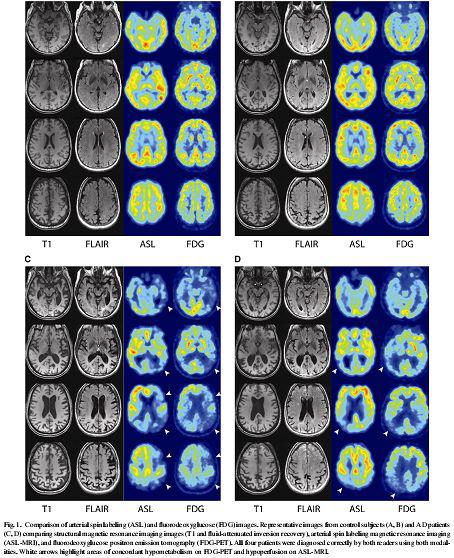
در پروسه تشخیصی آلزایمر با استفاده از MRS، لوبهای پاریتال ،فرونتال و تمپورومدیال و لترال مورد مطالعه قرار میگیرند.در اکثر موارد از تکنیک تک واکسل استفاده میشود.انتخاب مکان ROI با توجه به دو عامل: پاتوفیزیولوژی بیماری و ملاحظات تکنیکی صورت میگیرد.برای نمونه در( neurofibrillary pathology) و تخریب نرونی قبل از همه تمپورال میانی درگیر می شود و ROI را محدود به این ناحیه قرار میدهیم. و جهت نمایان ساختن پیک متابولیتMI در ناحیه تمپورال میانی و هایپوکامپ نیاز به انتخابTE پائینتر از ۳۵ است…
ناحیه مهم دیگر posterior cingulate gyrus و inferior precunei است که کاهش فعالیتهای سیناپسی ناشی از بیماری آلزایمر در این ناحیه زودتر از نواحی دیگر آغاز می شود.
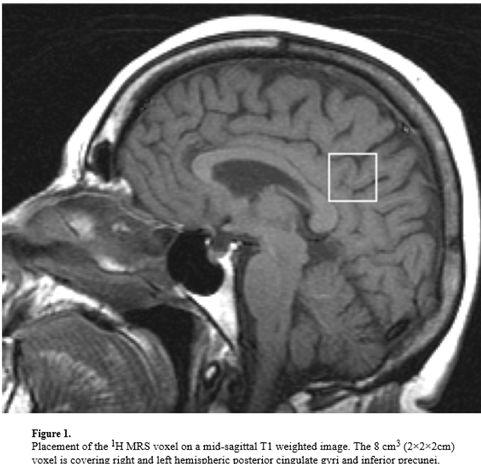
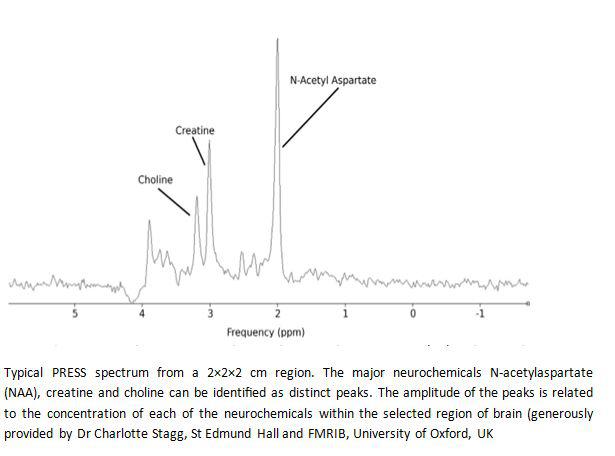
ارزیابی سطح متابولیت های مختلف و ارتباط آن با آلزایمر:
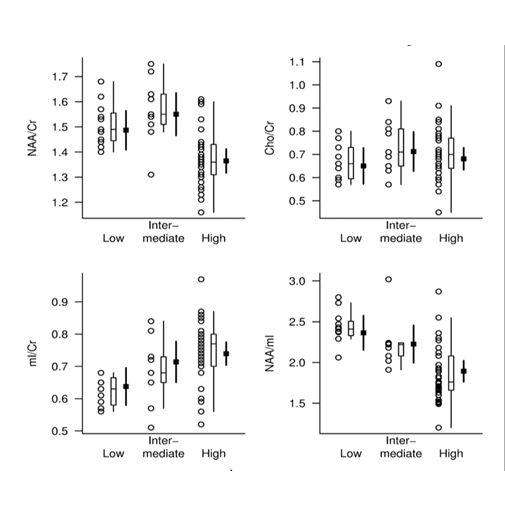
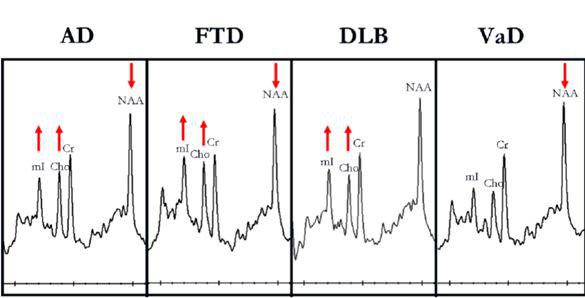
کاهش سطح NAA/Cr در posterior cingulate, bilateral hippocampus در بیماران آلزایمر ی در مقایسه با افراد سالم
افزایش نسبتMI/Cr در بیماران مبتلا نسبت به گروه نرمال به خصوص در posterior cingulate ,parietal gray matter
تغییرات در سطح MI/Cr در مراحل اولیه بیماری و کاهش سطح NAA/Cr در مراحل انتهای بیماری مشهود تر است
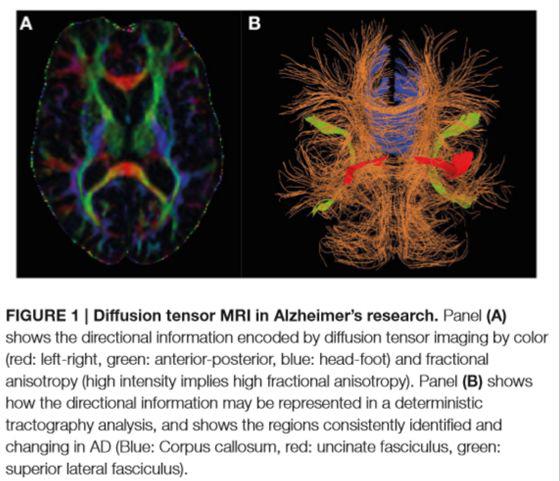
تصویربرداری(DTI) : یافته های به دست آمده از تصاویر آناتومیکال نشان می دهد که بیماران آلزایمر ی غالبا دچار آتروفی در ناحیه هایپوکامپ و entorhinal هستند و نیز مطالعات PET /SPECT کاهش عملکرد و متابولیسم را در ناحیه posterior cingulate نشان می دهند،اما با این وجود تکنیکهای فوق نمیتوانند مشخص کنند کدام یک از ناهنجاریهای الیاف Cingulam را که لوب تمپورال میانی و ناحیه سینگولیت خلفی را بهم وصل میکنند تحت تاثیر قرار می دهد.لذا از روش DTI در تشخیص میزان تخریب الیاف ماده سفید با استفاده از دو فاکتور Fractional anisotropy و mean diffusivity استفاده میشود.
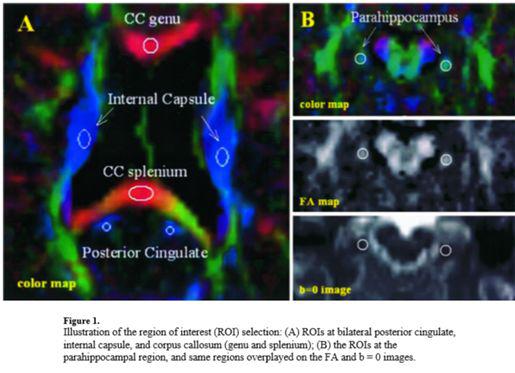
نتایج حاصل از Fractional anisotropy: در بیماران آلزایمر: کاهش نسبی FA در هایپوکامپ و posterior cingulate
کاهش چشمگیر FA در اسپلنیوم
در بیمارانMCI: کاهش نسبی FA در هایپوکامپ و posterior cingulate
کاهش کمتر FA در اسپلنیوم در مقایسه با آلزایمر
نتایج حاصل از mean diffusivity: بیانگر نسبت میانگین دیفیوژن در طول سه محور دیفیوژن تنسور است که به water content و totuosity کلی محیط بستگی دارد.
در بیماران مبتلا به آلزایمر: افزایش MD در هایپوکامپ و posterior cingulate
در بیماران MCI: افزایش جزییMD فقط در left posterior cingulate
لذا میتوان گفت میزانMD در left posterior cingulate معیار مناسب برای افتراق آلزایمر از MCI است.
و نیز با توجه به وجود بیشترین اختلاف بین بیماران آلزایمر و MCI نرمال در اندازهFA ناحیه left posterior cingulate است از این روش میتوان جهت طبقه بندی و افتراق سه گروه استفاده کرد
دمانس عروقی(vascular dementia): بعد از آلزایمر دومین علت شایع دمانس است که با نام دمانس مولتی انفارکت خوانده میشود.یک شکل غیر قابل برگشت از انواع دمانس است که به وسیله دنباله ای از انفارکت های کوچک در مغز رخ می دهد.
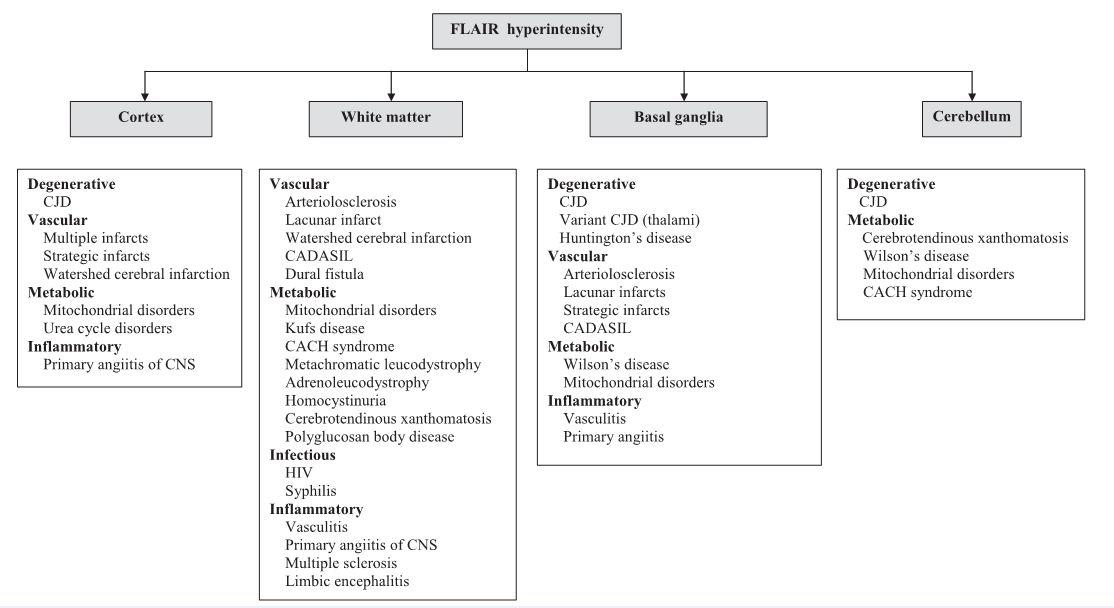
بررسیهای ساختاری: تصویربرداری با استفاده از ام آر آی حساسیت بالاتر ی در کشف تغییرات پاتولوژی مرتبط با بیماری های عروقی نسبت به سی تی اسکن دارد .گزینه های متعدد تصویربرداری جهت کشف مقیاسی از یافته ها از انفارکت قشری بزرگ تا انفارکت کوچک در نواحی حیاتی و میکروخونریزی ها و توده های منتشر ماده سفید مغز وجود دارد
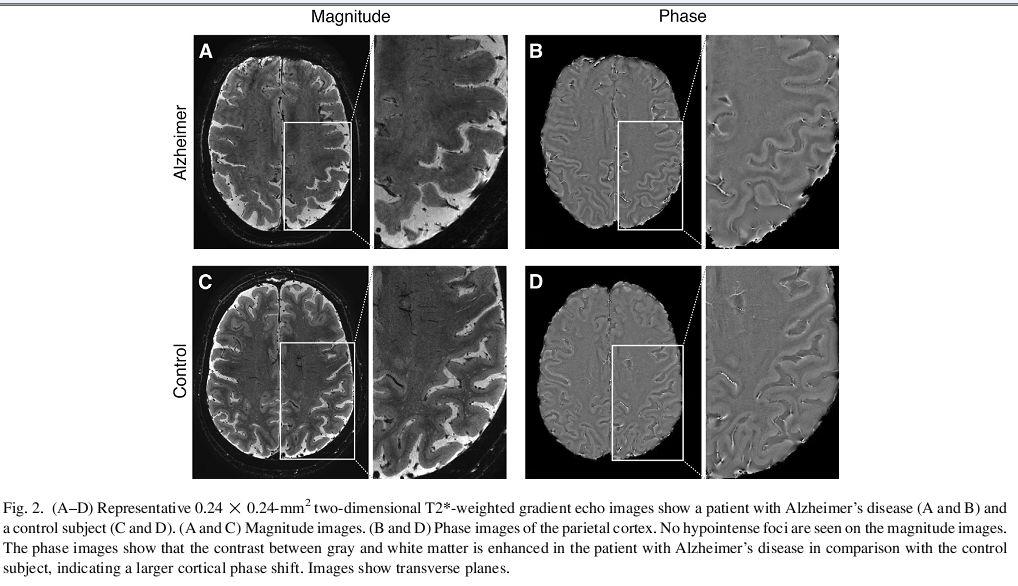
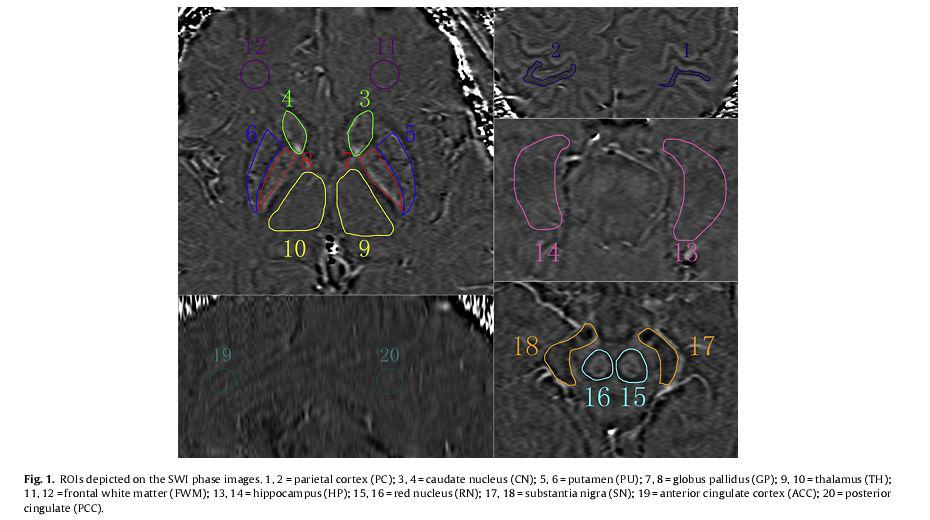
تصاویر گرادیان اکو *T2 و وزن پذیرفتاریSWI :
نقش این دو سکانس در کشف میکروخونریزی در بافت پارانشیم مغز است .اگر چه میکروخونریزی مغزی در حدود ۱۰% از افراد مسن مشاهده میشود ولی افزایش تعداد آن در عمق بافت مغز میتواند در ارتباط با افزایش خطر دمانس باشد.در مطالعات با مگنت۳T با وزن SWI کانونهای کوچک بارز با افزایش دانسیته در ۸۶% بیماران مبتلا به VaD در مقایسه با ۵۴% از نوع lewy body dementia و ۴۸% از نوع آلزایمر مشاهده شده است.در بیماران آلزایمر و lewy body dementia یک تقدم در انتشار لوبار میکروخونریزی ها نسبت به بیماران VaD و MCI وجود دارد.
تشخیص دمانس عروقی معمولا با ترکیب سابقه کلینیکی و تصاویر آناتومیکال انجام می شود .دمانس عروقی می تواند با آلزایمر هم ارتباط داشته باشد و در این موارد PET/SPECT می تواند جهت تشخیص دو پاتولوژی بکار گرفته شود .در مورد Spect معمولا دو رادیو دارو به عنوان هدف ردیابی برای نمایش پرفیوژن ناحیهای مغز استفاده میشود: تکنسیوم ۹۹ HMPAO و تکنسیوم ۹۹ ECD
رادیو داروی اول در بیماران دمانس عروقی کاهش پرفیوژن در یک یا بیشتر از یک حوزه عروقی را به طور روتین نشان می دهد و به طور مشخص پرفیوژن بازال گانگلیا را نیز داریم. در مواردی که هر دو بیماری شامل دمانس عروقی و آلزایمر کشف و کاهش پرفیوژن در هر دو ناحیه تمپوروپریتال خلفی و یک یا بیشتر از یک حوزه عروقی را شاهد خواهیم بود.CBF ناحیهای مغز با استفاده ازSPECT جهت تمایز دمانس عروقی از آلزایمر به عنوان روش قابل قبول مطرح است.
در بیماران با دمانس عروقیFDG_PET اغلب یک کاهش سراسری در متابولیسم مغز با نواحی کانونی کاهش متابولیسم نامتقارن که نواحی قشری و تحت قشری و توزیع بافتی مغز را درگیر کرده،مشاهده میکنیم.این الگوهای متابولیسم با آنچه در آلزایمر وجود دارد متفاوت است.جایی که نواحی دو طرفه از کاهش متابولیسم در لوبهای پاریتوتمپورال با کاهش نسبی حجم ساختارهای تحت قشری را داریم..
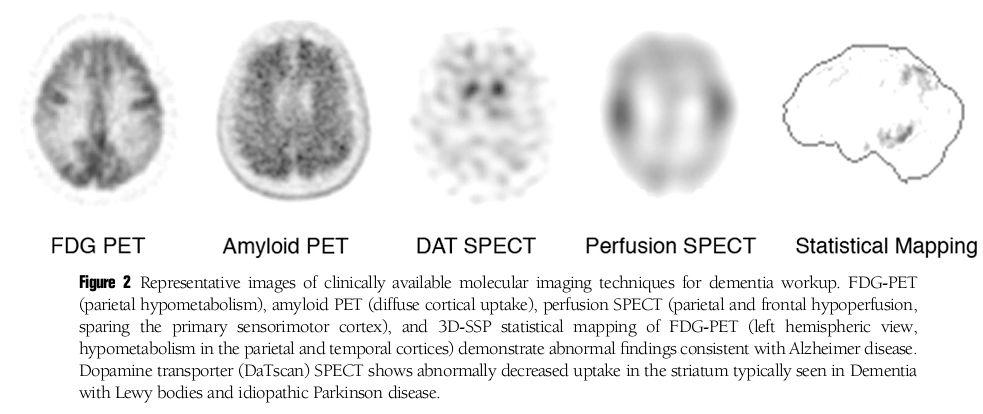
سطحMI/Cr کورتیکال در بیماران VaD نرمال است .از آنجایی که سطح این متابولیت در آلزایمر بالا می رود لذا سطح آن می تواند به شناسایی بیماران آلزایمر در cerebrovascular disease کمک کند.
مطالعاتMRS نشان میدهد که سطح NAA/Cr در بیماران مبتلا به VaD کاهش پیدا میکند.سطح متابولیت NAA در دمانس عروقی بسیار پایین تر از آلزایمر است که نشان می دهد در VaD با آسیب ایسکمیک ماده سفید و در آلزایمر با آسیب دژنراتیو کورتکس مغز مواجه هستیم.بیشترین کاهش سطح NAA مربوط به بیماران همراه با اختلال شناختی است.البته باید دقت شود که سطحNAA در بیماران استروکی که اختلال شناختی دارند نسبت به بیماران استروکی که از این لحاظ سالم هستند بسیار پایین تر است لذا از همین موضوع میتوان به عنوان مارکری جهت تشخیص neuronal dysfunction ،حتی در مناطقی فراتر از ناحیه انفارکت استفاده کرد.
Dementia with lewy body:
بیماری دمانس جسم Lewy با تظاهر کلینیکی شبیه به بیماران پارکینسون ،شامل نقص در عملکرد و توهم دیداری شناخته میشود. DLB و بیماری پارکینسون هر دو در ارتباط با نقص در سلولهای تولید کننده دوپامین و انباشت ذرات آلفا سیناکلین که به صورت جسم Lewy متراکم میشوند ،است.این دو بیماری به جهت کلینیکی شبیه هم هستند و مشخصه پارکینسون کاهش علایم پیش از موعد در قوای محرکه ادراکی در ۱۲ ماه است.
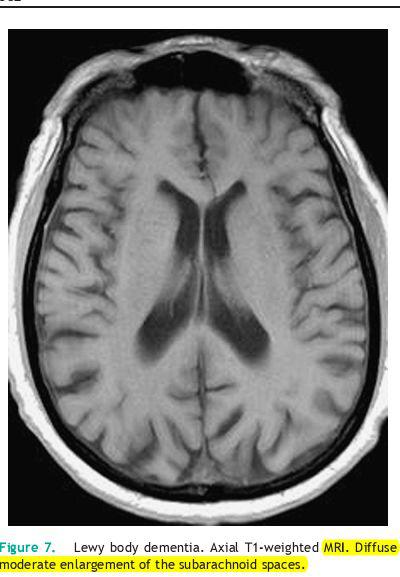
تصویربرداری ام آر آی تفاوت بین DBL و AD در ارتباط با آتروفی ناحیهای را نمایش می دهد.بیماران مبتلا به DBL تمایل به ایجاد آتروفی بزرگتر در striatum و مغز میانی و هیپوتالاموس و نیز آتروفی نسبتا کم در هایپوکامپ را دارند.
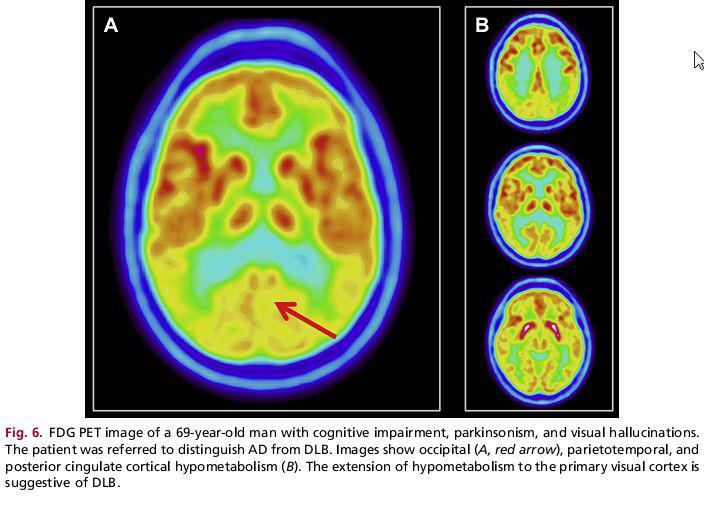
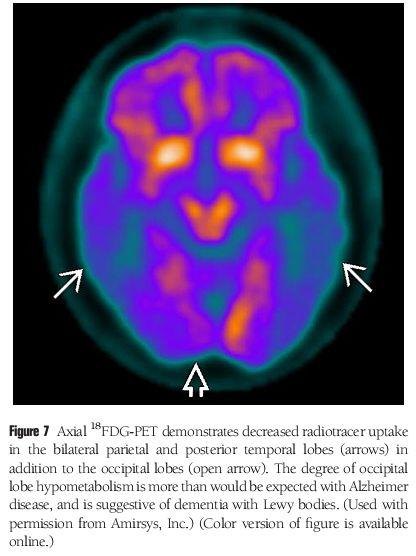
در تصویربرداری با FDG_PET/SPECT تظاهر و نمایش آلزایمر و DLB بسیار شبیه است به طوری که یک درگیری در ناحیه پاریتوتمپورال در هر دو وجود دارد.بهر حال کاهش متابولیسم گلوکز در کورتکس بینایی بیماران DLB دیده میشود که میتواند به عنوان یک تمیز دهنده مفید باشد.یافته دیگر کاهش متابولیسم در کورتکس اکسیپیتال طرفی و ثبات متابولیسم نسبی در cingulate gyrus میانی و خلفی است
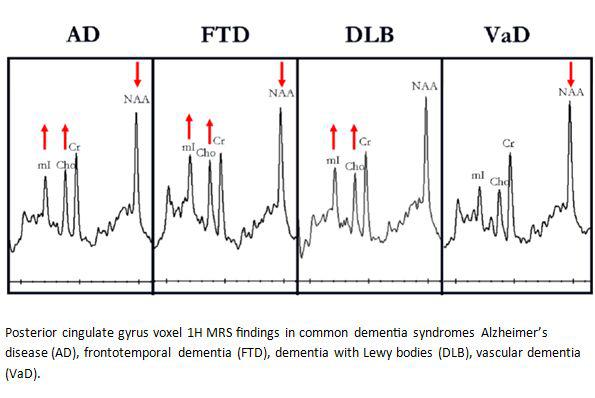
برخلاف سایر دمانس ها در مطالعاتMRS در بیماریDLB سطح NAA/Cr نرمال باقی می ماند .نرمال بودن سطح این متابولیت در posterior cingulate gyrus نشان یکپارچگی نورونی در این ناحیه است که مارکر قابل اطمینانی در تشخیص افتراقی DLB از سایر دمانس ها است.
در مورد سطح Cho/CR نیز شاهد افزایش در تمام بیماران مبتلا هستیم،که احتمالا به دلیل افزایش حجم غشا به علت مرگ ناگهانی نوروپیل است.
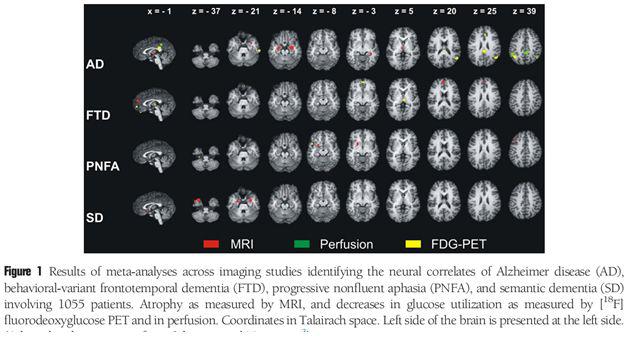
دمانس فرونتوتمپورال(FTD) : گروهی از بیماری ها را شامل میشود که باعث تخریب لوب فرونتال و یا لوب تمپورال قدامی یا هر دو را میشوند.این بیماری سومین علت عمده دمانس در کشورهای صنعتی است. به طور کلینیکی به سه زیر شاخه بر مبنای الگوهای رفتاری تقسیم میشود: دمانس فرونتوتمپورال با رفتار متغیر(bv FTD) , دمانس معنایی(SD) و عدم تکلم فصیح پیشرونده pNFA
علایم این بیماری گاهی اوقات با علایم آلزایمر تداخل دارد و منجر به تشخیص اشتباه میشود که با تصویربرداری فانکشنال و آناتومیکال میتوان بین این دو تمایز ایجاد کرد
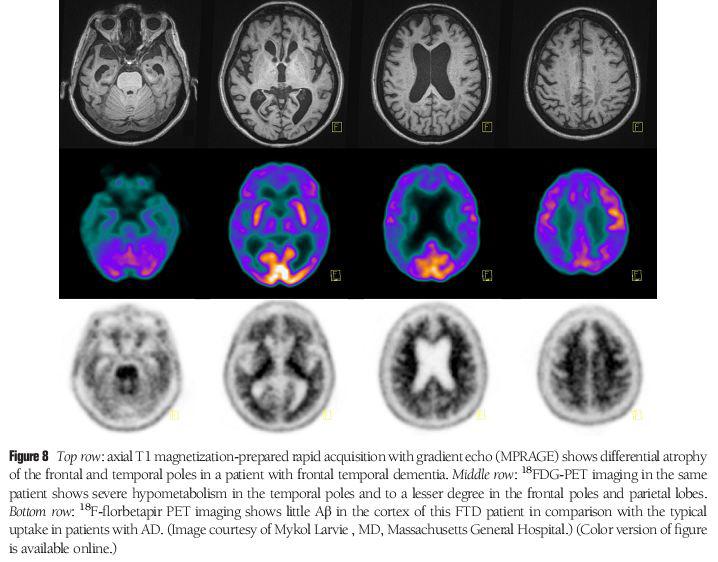
الگوی آتروفی بر اساس زیر شاخه های بیماری متفاوت است ولی به طور واضح در لوب تمپورال و فرونتال وجود دارد.در زیر گروه دمانس معناییSD یک الگوی آتروفی شدید شبیه لبه چاقو همیشه در لوب تمپورال قدامی یافت می شود.کورپوس کالوزوم میتواند با یک الگوی آتروفی با درجاتی از وخامت در قسمتهای قدامی دیده شود.این یافته ها تضاد آشکار با آتروفی پینه دار و سخت مشابه آنچه در آلزایمر دیده می شود، که بیشتر در قسمت خلفی بروز میکند،دارد.
در دو زیر گروه رفتار متغیر و دمانس معنایی با یک الگوی تخریب در نواحی مثل بخش میانی لوب تمپورال و اینسولای دو طرف و کورتکس سینگولیت قدامی چپ،مشخص میشوند.
در زیر شاخهPNFA یک الگوی آتروفی گزینشی در ناحیه پری سیلوین چپ داریم.این یافته ها و خصوصیات آناتومیک را میتوان در تمایز این نوع بیماران از افراد سالم تحت کنترل بکار برد.اندازه گیری ضخامت قشر مغز میتواند جهت تمایز آتروفی ناحیهای در آلزایمر و bvFTD مفید باشد.
با توجه به الگوهای آتروفی بسته به زیر گروه های FTD وجود الگوهای کاهش متابولیسم قابل رصد در تصویربرداری پزشکی هستهای اغلب متفاوت است،بخصوص کاهش متابولیسم لوب فرونتال که مرتبط با bvFTD است و کاهش متابولیسم لوب تمپورال مرتبط با SD و کاهش متابولیسم پری سیلوین چپ مرتبط با PNFA وجود دارد.وقتی بخواهیم بین آلزایمر و FTD تمایز قایل شویم تصویربرداریFDG_PET بسیار مفید است.نمایش کاهش پرفیوژن در نواحی فرونتال و تمپورال در SPECT بطور مشخص جهت تفکیک این دو بیماری مفید است.
تصاویر پرفیوژن ام آر آی،حاصل از تکنیک ASL در بیماران مبتلا بهFTD الگوهای کاهش پرفیوژن همسو با نتایج PET و پزشکی هستهای را نمایش می دهد.الگوهای کاهش پرفیوژن دو طرفه در کورتکس فرونتال و اینسولا در این تکنیک دیده می شود.علاوه بر این افزایش پرفیوژن در سینگولیت خلفی ، میتواند بیانگر اثر جبرانی مغز باشد.تصاویر ASL می تواند در تمایز بین bvFTD از آلزایمر با ۸۰% صحت بکار گرفته شود.
تغییرات متابولیتی MRS در Frontotemporal dementia بسیار شبیه آلزایمر است.به این صورت که در بیماران مبتلا نسبت به گروه نرمال NAA/Cr کاهش و MI/Cr افزایش نسبی دارد.البته در کورتکس بیماران مبتلا به FTLD نسبتNAA/Cr پایین تر و نسبت MI/Cr بالاتر از بیماران آلزایمر ی است،لذا اندازه گیری های ناحیهای اسپکتروسکپیک میتواند به افتراق اختلالات نورودژنراتیوی که تنها ناحیه خاصی را درگیر میکنند، کمک کند.
منبع: گروه تلگرام Optimizing MRI Sequences
تهیه کننده : جناب آقای شیخی