دیفیوژن یک سکانس نیست بلکه یک کنتراست است. همانطور که کنتراستT1 و T2 بر اساس اختلاف زمان آسایس T1 و T2 بافتهای مختلف و کنتراست PD بر اساس غلظت و فراوانی پروتون هیدروژن در بافتهای مختلف است؛ واژه ی دیفیوژن به معنی انتشار است و کنتراست دیفیوژنی نیز بر اساس اختلاف انتشار مولکولهای آب در بافتهای مختلف است.
حال که دانستیم دیفیوژن یک سکانس نیست بلکه یک کنتراست است؛ بحث را با چگونگی ایجاد این کنتراست ادامه می دهیم. برای ثبت انتشار مایعات در کنتراست دیفیوژن، ابتدا باید این مولکولهای مایع را مشاهده کرد و برای دیدن مولکولهای مایع، نیاز به استفاده از پروتکلی با کنتراست T2w یا T2*w هست.
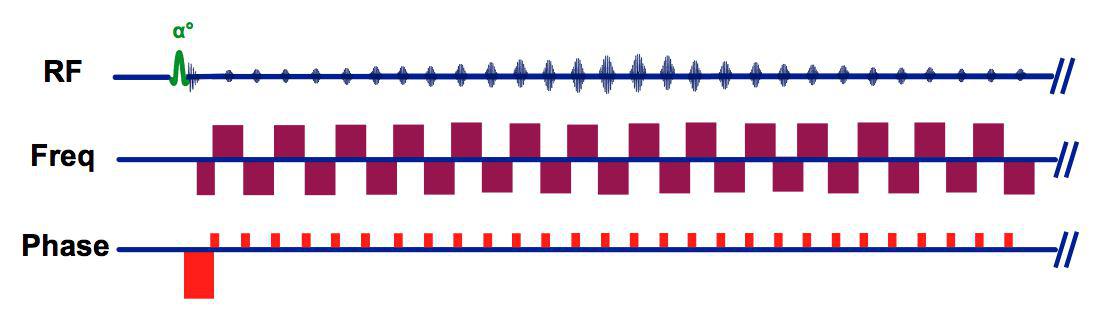
این پروتکل می تواند از هر خانواده ی تصویربرداری باشد. اعم از SE یا FSE یا IR و یا GRE. حال که کنتراست T2 را بدست آوردیم؛ برای ثبت انتشار و حرکت این مولکولها، یک جفت گرادیان دوقطبی بر روی این پروتکلِ با وزن T2 یا T2* اضافه می کنیم. این جفت گرادیان دوقطبی، همان گرادیانهای معروف دیفیوژنی هستند که به b value تعبیر می شوند.
در حقیقت، کنتراست دیفیوژن چیزی جز یک گرادیان دو قطبی و بعبارتی یک b value نیست.
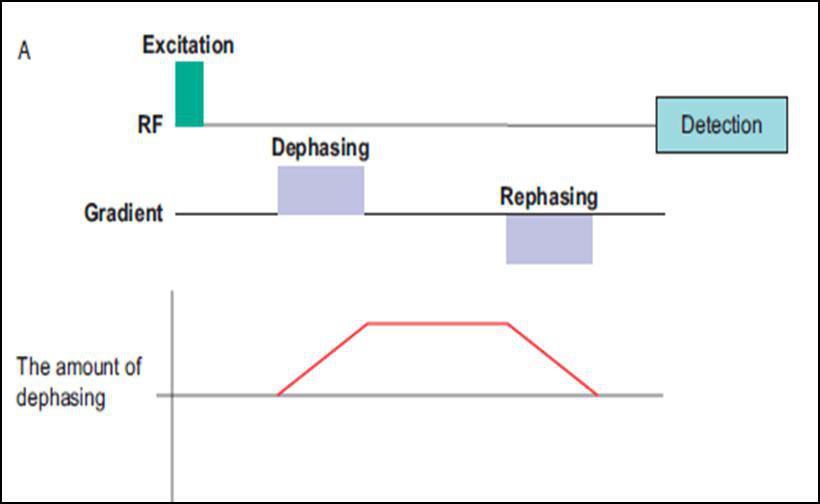 شکل یک. الف. دیاگرام کنتراست دیفیوژن بر روی سکانس T2*w GRE
شکل یک. الف. دیاگرام کنتراست دیفیوژن بر روی سکانس T2*w GRE
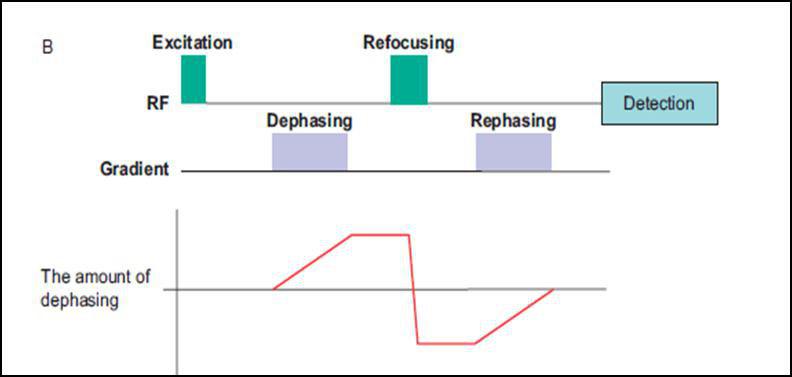 شکل یک. ب . دیاگرام کنتراست دیفیوژن بر روی سکانس T2w SE
شکل یک. ب . دیاگرام کنتراست دیفیوژن بر روی سکانس T2w SE
همانطور که مشاهده می شود؛ مستطیل های بنفش رنگ در واقع همان گرادیان های دیفیوژنی با قطب های مخالف هستند که در سکانس با پایه اسپین اکو، به دلیل وجود پالس ۱۸۰ درجه در مابین ایندو قطب که نقش همفاز کنندگی را دارد، هر دو لوب گرادیان دیفیوژنی، یک جهت دارند
در ادامه، به نقش b value در ایجاد و تعیین کنتراست دیفیوژن می پردازیم.
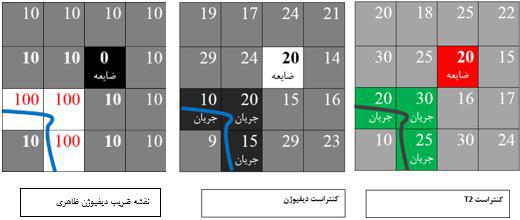
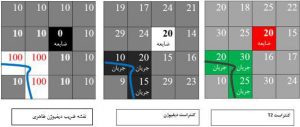
اگر فرض کنیم یک تصویر فرضی با ماتریس ۴x4 داشته باشیم که به کمک کنتراست T2w SE یا T2*w GRE به دست آمده باشد؛ (شکل شماره ۲ ) که این تصویر متشکل از پیکسلهایی حاوی بافت نرمال (پیکسلهای خاکستری)، بافت دارای جریان (پیکسلهای سبز) و یک پیکسل دارای ضایعه به طور مثال سکته (پیکسل قرمز) باشد و هر کدام بسته به ماهیت خود، دارای شدت سیگنالی هستند. (اعداد داخل پیکسل، که بر اساس مکانیسم و چگونگی کنتراست T2 ناشی از برهمکنش اسپین ها و همینطور نقش ناهمگن بودن میدان مغناطیسی در به هم ریختن و تشدید این برهمکنش، که موضوع بحث ما نیست).
 شکل شماره ۲٫ تصویر فرضی با کنتراست T2
شکل شماره ۲٫ تصویر فرضی با کنتراست T2
اکنون میخواهیم کنتراست دیفیوژنی را از این تصویر بدست آوریم.
برای توصیف کنتراست دیفیوژنی، ذکر این نکته ضروری است که در حالت عادی در بافتهای مختلف و به صورت فیزیولوژیک، مولکولهای آب در حال انتشار و حرکت اند که این انتشار دارای یک رِنج نرمال و متناسب با ماهیت بافت است. برای نمونه در مغز، حرکت مولکولهای آب در داخل بافت سفید کمتر از بطن، و بطن کمتر از عروق است و در یک سکته که پر از ترافیک پروتون هیدروژن شده است؛ حرکت مثل باتلاق متوقف و نزدیک به صفر است.
از آنجا که در ام آر آی، حرکت مساوی است با دفازه شدن و به دنبال آن، از دست رفتن سیگنال، از همین اصل در تصویربرداری دیفیوژن کمک گرفته می شود و بنابرین هرچه یک بافت، در حد فاصل بین دو قطب گرادیان مثبت و منفی اعمال شده بر روی تصویر T2، دارای سرعت حرکت یا انتشار مولکولی بالاتری باشد؛ پس بیشتر دفازه شده و دامنه سیگنال آن افت بیشتری پیدا کرده و در پیکسل تصویر با کنتراست دیفیوژنی، تیره تر دیده خواهد شد.
همانطور که در بالا ذکر شد و در شکل شماره یک مشاهده شد؛ برای اندازه گیری و نمایش میزان انتشار مولکولهای یک بافت که اساس کنتراست دیفیوژنی را می سازد؛ نیازمند اضافه کردن یک جفت گرادیان دو قطبی به پروتکلِ دارای کنتراست T2w یا T2*w هستیم.
با سوار شدن و اعمال قطب های مثبت و منفی این گرادیان دو قطبی دیفیوژنی بر روی پروتکل، ابتدا با توجه قطب اعمال شده (مثلا قطب مثبت)، یک مقدار عددی به دامنه ی سیگنال تک تک پیکسل ها اضافه می شود. پس از خاموش شدن قطب مثبت و گذر یک مدت زمان، ( فاصله ی زمانی بین قطب مثبت و منفی قطب های گرادیان دیفیوژنی) حال قطب منفی که شدت و مدت این قطب دقیقا برابر است با قطب مثبت ولی منتها دارای جهت اعمالی مخالفی است؛ دقیقا همان مقدار عددی از دامنه سیگنال و بعبارتی از اعداد داخل هر پیکسل کم می شود.
این مقدار عددی اضافه و یا کم شده، در حقیقت همان مقدار بزرگی b value هست. و این عدد انتخابی، متغیر و بر اساس ماهیت ضایعه و همینطور آناتومی مد نظر، تغییر میکند. هرچه b value بزرگتر، امکان و فرصت انتشار بیشتر، و درنتیجه تغییر فاز پروتون آب و اُفت دامنه سیگنال آن، بیشتر است.
به عبارتی دیگر، هر چه b value عدد بزرگتری باشد؛ مقدار SNR تصویر بیشتر افت میکند اما در عوض، CNR یا نسبت کنتراست به نویز بالا می رود و امکان تشخیص افزایش پیدا میکند.
اما نباید فراموش کرد که بسته به آناتومی و همینطور ماهیت و نوع ضایعه، باید یک تعادل را بین SNR و CNR کنتراست دیفیوژن برقرار کرد.
پس از اعمال گرادیان دوقطبی دیفیوژن و اندازه گیری میزان انتشار مولکولهای آب تک تک پیکسلها و ثبت عددی آن، اکنون دارای دو تصویر هستیم که یکی همان تصویر اولی که با وزن T2 یا T2* و بدون اعمال جفت گرادیان دو قطبی دیفیوژنی بدست آمد (شکل ۲) و دیگری تصویر با کنتراست دیفیوژنی (شکل ۳).
 شکل ۳٫ تصویر فرضی کنتراست دیفیوژن
شکل ۳٫ تصویر فرضی کنتراست دیفیوژن
حال به شرح اتفاقات رخ داده و نحوه اندازه گیری و رنگ آمیزی کنتراست دیفیوژن اشاره می کنیم.
اگر به شکل فرضی شماره ۳ مجددا نگاه کنیم؛ می بینیم که پیکسلهای بافت نرمال (خاکستری) به دلیل حرکت براونی مولکولی نرمال و نسبتا کم، دارای تغییرات جزئی در دامنه سیگنال شده (در این مثال فرضی به اندازه ی یک واحد) و تقریبا با همان رنگ خاکستری (کمی تیره تر) در تصویر با کنتراست دیفیوژنی هم مشاهده می شود. اما اگر به پیکسلهای سبز (جریان) دقت کنیم می بینیم که به دلیل سرعت بسیار بالای انتشار مولکولها در این پیکسلها، تغییر فاز هم بسیار زیاد بوده و افت زیاد دامنه سیگنال (در این مثال فرضی به اندازه ۱۰ واحد) منجر به تیره شدن پیکسلها در تصویر با کنتراست دیفیوژن شده است. حال به پیکسل قرمز رنگ (سکته) در شکل سه که مربوط به کنتراست دیفیوژن است؛ دقت کنید. از آنجایی که در این ضایعه به علت تورم سلولی و Restriction و محدودیت ایجاد شده، انتشار مولکولی تقریبا متوقف شده است. این بدان معناست که دامنه ی سیگنال این پیکسل به دلیل عدم انتشار، دچار افت در دامنه ی سیگنال نمی شود.
الگوریتمی که برای رنگ آمیزی کنتراست دیفیوژن قرائت می شود بر این اساس استوار است که هر پیکسلی که پس از اعمال گرادیان دو قطبی دیفیوژن، به هر دلیلی تغییرات فاز نداشته باشد؛ پس تقریبا افتی در دامنه ی سیگنال نداشته و با بالاترین رنگ (سفید) بیان شود و هر پیکسلی که پس از اعمال گرادیان دو قطبی دیفیوژن، به دلیل بیشترین میزان انتشار، دچار تغییرات فاز شود؛ پس دچار افت در دامنه ی سیگنال شده و با پایین ترین رنگ (سیاه) بیان شود و مابقی پیکسل ها نیز بر اساس حدفاصل حداقل و حداکثر انتشار، در طیف Gray scale با یک رنگ بین سیاه – خاکستری – سفید قرائت می شوند.
 تصویر فرضی مربوط به کنتراست T2 و دیفیوژن
تصویر فرضی مربوط به کنتراست T2 و دیفیوژن
بر همین اصل و اساس، تصویر کنتراست دیفیوژن بر ما روشن میدارد که هر پیکسل یا بعبارتی هرناحیه ایی از تصویر، تیره باشد بدان معنی است که در آن انتشار بالا بوده است و هر ناحیه ایی از تصویر که روشن باشد یعنی در آنجا انتشار حداقل یا صفر بوده است.
اگر به شکل ۴ مربوط به کنتراست دیفیوژن بر پایه T2w –SE در مغز است؛ نگاه کنید مشاهده می کنید که نواحی مربوط به بطن و CSF به دلیل انتشار بالای مولکولهای آب در حد فاصل اعمال گرادیان دو قطبی دیفیوژن، دارای بیشترین مقدار دفازه شدن، بیشترین مقدار افت سیگنال و درنتیجه، تیره ترین رنگ است. و آنجا که سکته اتفاق افتاده است؛ به دلیل حداقل میزان انتشار، دارای کمترین مقدار دفازه شدن، کمترین مقدار افت سیگنال و درنتیجه، روشن ترین رنگ است.
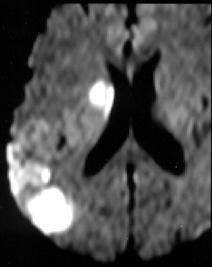 شکل ۴ . کنتراست دیفیوژن در مغز در بیمار مبتلا به سکته
شکل ۴ . کنتراست دیفیوژن در مغز در بیمار مبتلا به سکته
به این ترتیب، کنتراست دیفیوژن قبل از تغییرات آناتومیک و در حین تغییرات فیزیولوژیک در نمایش یک پاتولوژی در حال اتفاق، می تواند به ما کمک کند.
اما همیشه در کنتراست دیفیوژن، نواحی روشن به نفع پاتولوژی نیستند. گاه به دلیل آرتیفکت t2 shine through (آرتیفکت درخشندگی مصنوعی) نواحی از آناتومی مد نظر، روشن دیده می شود.
برای غلبه بر این آرتیفکت، یک تصویر بازسازی شده از دو تصویر قبلی، یعنی T2w و دیفیوژن، به نام ضریب دیفیوژن ظاهری یا Apparent Diffusion Coefficient تهیه شد.
این نقشه یا تصویر، همانطور که از اسمش پیداست؛ بر اساس محاسبه ی پیکسل به پیکسلِ میزان یا ضریبِ انتشار مولکول آب، در کنتراست دیفیوژن نسبت به کنتراست T2w ساخته می شود. اگر به شکل۵ نگاه کنید؛ در تصویر مربوط به کنتراست T2، شدت سیگنال نواحی بطن و همینطور ضایعه، بالا و شدت سیگنال بافت سفید هم خاکستری تیره است. حال اگر به تصویر با کنتراست دیفیوژن همان بیمار نگاه کنید؛ مشاهده میکنید که به دلیل انتشار بالا، csf داخل بطن دچار دفازینگ و واپاشی سیگنال شده و تیره دیده می شود ولی ضایعه به دلیل عدم انتشار، دچار افت سیگنال نشده و همچنان روشن دیده می شود.
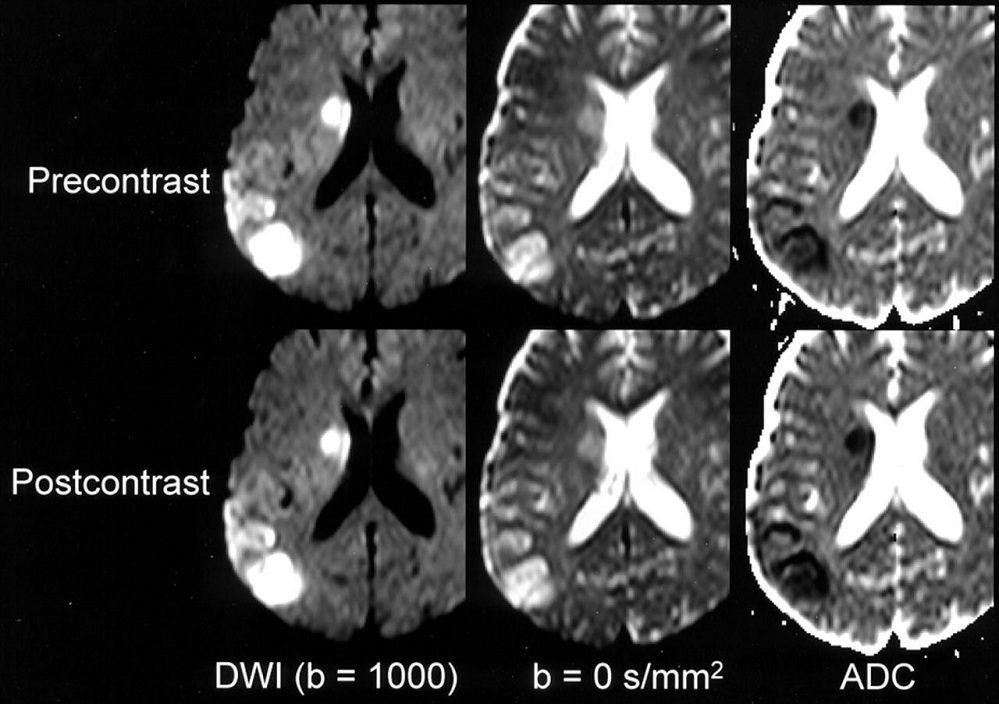 شکل ۵٫ از چپ به راست مربوط به تصاویر با کنتراست دیفیوژنی با بزرگی b value = 1000sec/mm2 و تصویر وسط مربوط به کنتراست T2*w و بدون اعمال گرادیان دیفیوژنی. و تصویر سمت راست مربوط به نقشه ADC
شکل ۵٫ از چپ به راست مربوط به تصاویر با کنتراست دیفیوژنی با بزرگی b value = 1000sec/mm2 و تصویر وسط مربوط به کنتراست T2*w و بدون اعمال گرادیان دیفیوژنی. و تصویر سمت راست مربوط به نقشه ADC
حال در نقشه ADC بازسازی شده در همین تصویر شماره ۵ نگاه کنید. از آنجا که ضریب تغییرات در نواحی مربوط به بطن، ماکزیمم بوده ( در کنتراست T2 روشن و در کنتراست دیفیوژن تیره) پس دارای بیشترین ضریب دیفیوژنی است و روشن ترین رنگ را در نقشه ADC به خود می گیرد. ناحیه مربوط به ضایعه هم به دلیل ضریب تغییرات دیفیوژنی بسیار کم ( در هر دو روشن هست) پس در نقشه ADC دارای کمترین ضریب تغییرات و درنتیجه دارای رنگ تیره است.
 تصویر شماتیک مربوط به کنتراست T2 , DWI, ADC
تصویر شماتیک مربوط به کنتراست T2 , DWI, ADC
پس هر سیگنال مشکوک به T2 shine در تصاویر دیفیوژن اگر در تصاویر ADC روشن می شد مشخص بود که آرتیفکت هست اما اگر پاتولوژی می بود به دلیل عدم تغییرات دامنه ی سیگنال، تیره دیده می شد و مجزا تشخیص داده می شد.
اما علاوه بر آرتیفکت درخشندگی مصنوعی، کنتراست دیفیوژن درگیر آرتیفکتهای دیگیری شد که مهمترین آنها شامل آرتیفکت حرکتی، بهم ریختگی، جابجایی شیمیایی، جریان گردابی بودند.
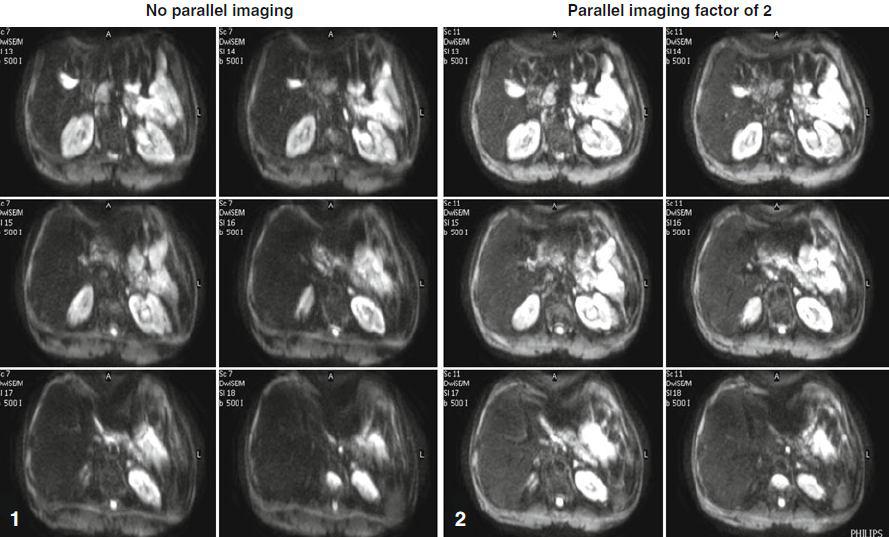
تکنیک تصویربرداری موازی یا Parallel Imaging به همراه استفاده از پهنای باند بزرگ، و سبک متفاوت در پر شدن فضای K، به همراه حذف چربی، در کنترل این آرتیفکت ها نقش بسیاری دارد.
 تصویربرداری موازی با فاکتور سرعت سه
تصویربرداری موازی با فاکتور سرعت سه
اگر به تصویر شماره ۱ نگاه کنید؛ ملاحظه میکنید که تصویربرداری موازی به دلیل اینکه خطوط فضای K را به صورت یک در میان پر می کند؛ در این شکل فاکتور سرعت تصویربرداری موازی ۳ هست که خطوط فضای K با مضرب سه پر می شوند (دو خط در میان) و بدین طریق احتمال خطای فازی را کاهش میدهد ( در حالت عادی تمام خطوط در یک TR و با سرعت بالا پر می شوند که احتمال خطای فازی و ثبت نابجای خطوط ، وجود دارد) . علاوه بر آن، به دلیل کاهش زمان اسکن، باعث کاهش احتمال آرتیفکت حرکتی نیز می شود.
در پروتکل GRE-EPI که به تصویربرداری صفحه ایی از اکو معروف هست و تمام خطوط فضای k در یک TR پر می شود و این اتفاق در کسری از ثانیه رخ می دهد. پس احتمال ثبت نابجای فازی خطوط سیگنال بسیار وجود دارد. ( شکل ۲، و ۳،)
 GRE-EPI diagram (single shot) شکل ۲٫
GRE-EPI diagram (single shot) شکل ۲٫
 شکل ۳٫ خطوط فضای k به صورت زیگزاگ پر می شوند.
شکل ۳٫ خطوط فضای k به صورت زیگزاگ پر می شوند.
با توجه به اشکال فوق، اگر از تصویربرداری موازی کمک گرفته نشود، احتمال خطای فازی و ایجاد آرتیفکت بهم ریختگی که مهمترین آرتیفکت در دیفیوژن است؛ بالا می رود
 شکل ۳٫ اصلاح آرتیفکت بهم ریختگی با استفاده از تصویربرداری موازی
شکل ۳٫ اصلاح آرتیفکت بهم ریختگی با استفاده از تصویربرداری موازی
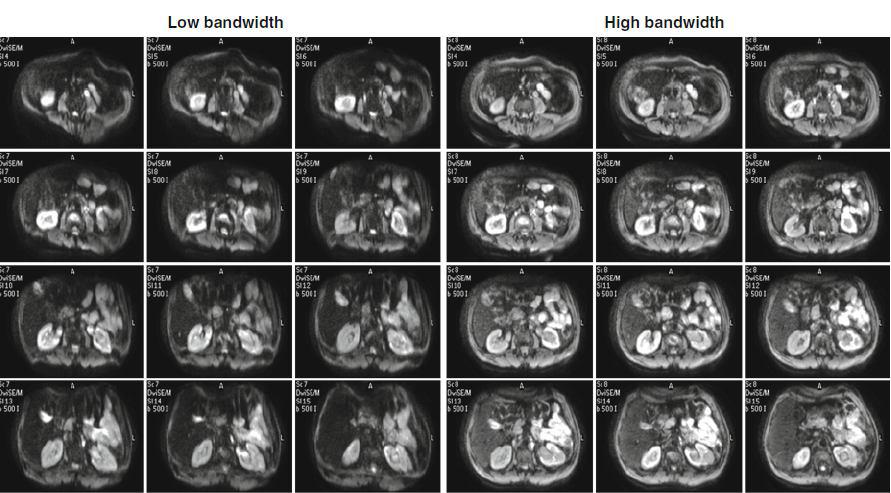 شکل ۴٫ افزایش پهنای باند باعث بهبود روند نمونه گیری (امکان افزایش تعداد نمونه در زمان کمتر) و کاهش آرتیفکت بهم ریختگی می شود.
شکل ۴٫ افزایش پهنای باند باعث بهبود روند نمونه گیری (امکان افزایش تعداد نمونه در زمان کمتر) و کاهش آرتیفکت بهم ریختگی می شود.
همینطور استفاده از کویلهای چند کاناله و بهره گیری از روشهای حذف چربی، در کاهش آرتیفکتهای جابجایی شیمایی ناشی از چربی موثر است.
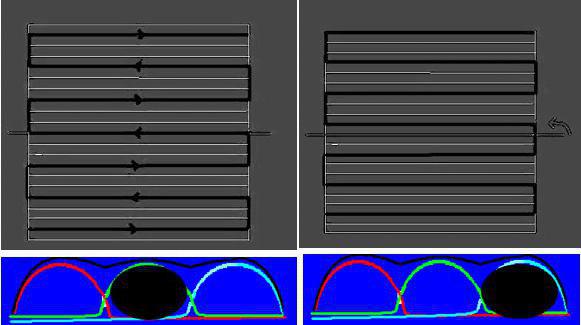
همچنین، به کمک روشهای مختلف پر شدن فضای K همانند اسپیرال و یا استفاده از سبک تصویرگیری Multishot به جای Single shot می تواند آرتیفکت بهم ریختگی را به ویژه در نواحی مستعد مثل ساقه مغز را کاهش دهد.
 شکل ۵٫ تصویربرداری Multi shot و single shot
شکل ۵٫ تصویربرداری Multi shot و single shot
در تصوبربرداری به سبک Single shot زمان اسکن کمتر است و به عبارتی تمپورال زرولوشن بالاتر است اما بیشتر مستعد ثبت خطای فازی و آرتیفکت بهم ریختگی است. ( این روش بر روی سکانس با پایه گرادیان اکو سوار است و به دلیل تمپورال رزولوشن بالا، در پرفیوژن DSC و fMR و DTI کاربرد دارد. در روش مالتی شات، هرچند که زمان اسکن بیشتر است ولی احتمال آرتیفکت بهم ریختگی به دلیل احتمال پایین تر خطای فازی، کمتر است. این ردش معمولا بر روی سکانس با پایه اسپین اکو اجرا می شود و در نواحی مستعد آرتیفکت مثل ساقه ی مغز و گوش کاربرد دارد.
کنتراست دیفیوژن به دلیل نیاز به سرعت انجام بالا و دفازینگ متعدد سیگنال در حین اعمال گرادیانهای دیفیوژنی، به صورت ذاتی داری SNR پایینی است که برای بهینه سازی و بهبود SNR تصاویر آن، می توان از افزایش ابعاد وکسل کمک گرفت (افزایش FOV و ضخامت مقطع و کاهش ماتریس تصویر ). چرا که تغییرات مثبت ابعاد وکسل، در زمان اسکن که برای دیفیوژن مهم است؛ حتی تاثیر مثبت دارد و کاهش ماتریس و بعبارتی تعداد گامهای کدگذاری فاز، زمان اسکن را کم میکند. اگر با این وجود، همچنان SNR تصویر دیفیوژن پایین بود می توان NEX یا Average را بالا برد.
گرچه کاهش BW میتواند باعث افزایش SNR شود اما به خاطر داشته باشیم در اینجا این کار اشتباه است چرا که به آرتیفکت جابجایی شیمیایی و حتی بهم ریختگی دامن میزند.
همین اصل درباره تصویربرداری موازی برقرار هست، با وجود کاهش SNR به دلیل استفاده از این تکنیک. اما بکار گیری این روش در هنگام تصویربرداری دیفیوژن، بسیار توصیه می شود حتی اگر برای جبران اثر کاهش SNR در آن، مجبور شویم NEX را افزایش دهیم. چرا که استفاده از تصویربرداری موازی (iPAT or ASSET) به طور قابل ملاحظه ایی باعث کاهش بهم ریختگی می شود و علاوه بر آن تمپورال رزولوشن را تا حدود N برابر بیشتر می کند.( N همان فاکتور سرعت در تصویربرداری موازی است)
البته ذکر این نکته خالی از لطف نیست که این تکنیک تنها بر روی کویلهای چندکاناله که همزمان و به طور موازی، کانالها را برای تصویربرداری به خدمت میگیرد؛ قابل اجراست.
کنتراست دیفیوژن کاربردهای متعددی دارد که بر همگان روشن است.
به قول یکی از همکاران رادیولوژیست، هرچقدر که تصاویر کنتراست دیفیوژن زشت هستند؛ اما ارزش تشخیصی بالایی دارند.???
سرآمد کاربردهای کنتراست دیفیوژن ، تشخیص زودهنگام سکته، حتی حدود نیم ساعت پس از وقوع است. از مهمترین کاربرد های کنتراست دیفیوژن می توان به افتراق توده از آبسه، کمک به تشخیص درجه برخیمی تومور. کمک به افتراق عود از نکروز بافت، نمایش عفونت ها و آبسه ها، موارد تروما ، بیماریهای دمیلینیشن مثل ام اس ، بررسی عملکردی بافت (پرفیوژن و fMR) و کمک به نمایش رشته های عصبی مغزی (ترکتوگرافی) و …
یکی از کاربردهای سکانس GRE- EPI-DWI در تکنیک پرفیوژن است. پرفیوژن به معنی تراوایی و نفوذپذیری است. در این تکنیک به کمک کنتراست دیفیوژن با پایه ی گرایان اکو به میزان ترواش و نفوذپذیری یک بافت در بستر مویرگی پرداخته می شود که Viability میزان یا زنده بودن بافت بررسی شود.
تکنیک پرفیوژن به دو روش با تزریق و بدون تزریق انجام می شود. روش بدون تزریق آن ASL نام دارد. روش با تزریق خود به دو صورت انجام می شود. یک روش با کمک کنتراست T1 است که اصطلاحا DCE نام دارد. دیگر روش که مورد بحث ماست چرا که به کمک کنتراست دیفیوژن (GRE_EPI) انجام می شود؛ DSC (Dynamic Susceptibility Contrast) نام دارد.
برای انجام صحیح DSC Perfusion باید ابتدا از مریض رگ گرفته شود و رابط به آنژیوکت وصل شود و بدون جابجایی تخت و مریض، اسکن انجام شود. ماده حاجب با پایه گادولینیوم را با حجم ۰/۲ mmol/kg به وسیله ی انژکتور و بسته به شرایط فیزیکی بیمار، با سرعت تزریق ۴ الی ۶ سی سی در ثانیه تزریق شود و بلافاصله حداقل ۲۰ سی سی نرمال سالین جهت جلوگیری از سریع قاطی شدن ماده حاجب با خون و کاهش سریع غلظت آن، تزریق می شود. شروع اسکن چند ثانیه قبل از شروع تزریق ماده ی حاجب است بطوریکه حدود ۱۰ تا ۲۰ ثانیه پس از شروع اسکن، ماده ی حاجب به مغز رسیده است. کل زمان اسکن بهتر است از حدود ۹۰ تا ۱۲۰ ثانیه بیشتر نباشد چراکه شاهد دومین گذر ماده ی حاجب از مغز خواهیم بود و در نمودار خروجی از این تکنیک، شاهد دو قله ی متفاوت و ناموزون خواهیم بود.
نحوه ی انجام: ابتدا سکانس GRE_EPI را به صورت آگزیال با تعداد برش مناسب و کافی برای پوشش ناحیه ضایعه چیده می شود. در این تکنیک باید حتما باید اولین گذر ماده ی حاجب از بستر مویرگی بررسی شود تا تفسیر درستی از نمودار TIC حاصل از این تکنیک، صورت بگیرد.
این سکانس با حدود ۵۰ سری یا measurement یا Volume و یا با تعداد بالاتر از این عدد، انجام می شود. به طوریکه کل تصاویر مربوط به حجم برش های مد نظر (حدود ۱۲ برش) را در یک الی دو ثانیه بدست می آورد و این کار را حداقل ۵۰ بار در ظرف ۹۰ الی ۱۲۰ ثانیه تکرار میکند. پس دارای رزولوشن زمانی بسیار بالایی است (هر ثانیه حدود ۱۰ تصویر) و تصاویر خروجی از این تکنیک، بسیار زیاد اند. (شکل ۱ )
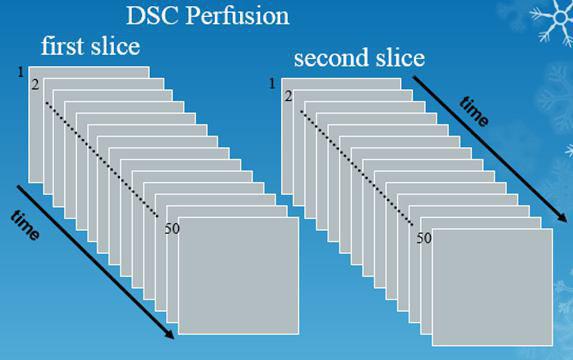 شکل ۱٫ برش ها و سری های شماتیک در پرفیوژن
شکل ۱٫ برش ها و سری های شماتیک در پرفیوژن
برای تفسیر و درک بهتری از این تکنیک، نمودار TIC از این سری های تصاویر تهیه می شود و از روی نمودار، چند متغیر اختصاصی این تکنیک مثل CBF, CBV, MTT و TTP استخراج می شود.
cerebral blood flow (CBF):
اشاره به سرعت جریان خون (ماده حاجب) از بستر مویرگی ناحیه مد نظر ( ROI مشخص شده بر روی ضایعه) دارد. (به عبارتی همان قسمت شیب نزولی نمودار TIC) با واحد ml/min/100gr
cerebral blood Volume (CBV):
اشاره به حجم جریان خون (ماده حاجب) از بستر مویرگی ناحیه مد نظر ( ROI مشخص شده بر روی ضایعه) دارد. (همان حجم دهانه V شکل در نمودار TIC)
Mean Transit Time (MTT):
اشاره به میانگین مدت زمان اولین گذر خون (ماده حاجب) از بستر مویرگی ناحیه مد نظر ( ROI مشخص شده بر روی ضایعه) دارد. (همان FWHM نمودار TIC)
Time To Peak (TTP):
اشاره به مدت زمان ابتدای ورود خون (ماده حاجب) به بستر مویرگی ناحیه مد نظر ( ROI مشخص شده بر روی ضایعه) تا به اوج (قله) رسیدن آن در روی نمودار دارد. (از زمان صفر تا قله ی نمودار TIC) (شکل ۲ و ۳ )
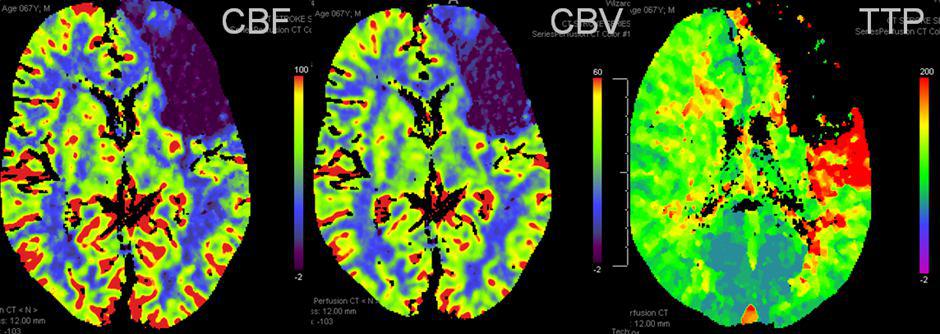 شکل ۲٫ نقشه های مربوط به پرفیوژن
شکل ۲٫ نقشه های مربوط به پرفیوژن
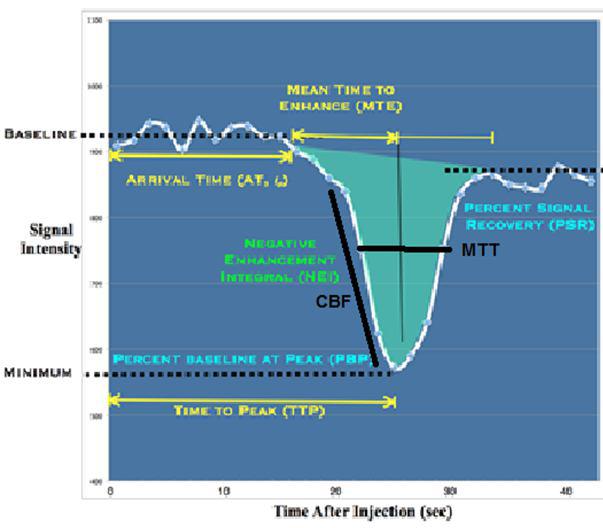 شکل ۳٫ نمودار TIC مربوط به متغیرهای پرفیوژن
شکل ۳٫ نمودار TIC مربوط به متغیرهای پرفیوژن
معمولا حدود ۱۰ ثانیه پس از شروع اسکن، ماده ی حاجب تزریق می شود و پس از رسیدن ماده ی حاجب به آناتومی برشها، دامنه ی سیگنال شروع به کاهش یافتن میکند. علت کاهش دامنه ی سیگنال، به تاثیر حضور ماده ی حاجب گادولینیم که یک عنصر پارامغناطیس است؛ برمی گردد. (شکل ۴)
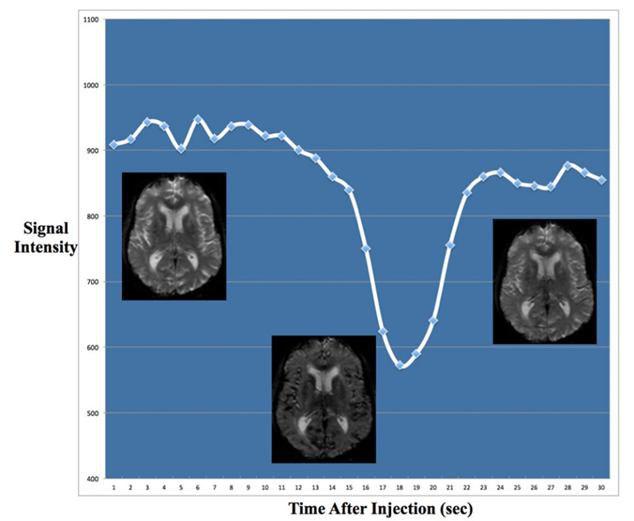 شکل ۴٫ کاهش سیگنال تصاویر پرفیوژن با ورود ماده حاجب گادولینیوم
شکل ۴٫ کاهش سیگنال تصاویر پرفیوژن با ورود ماده حاجب گادولینیوم
همانطور که این ماده ی حاجب باعث کاهش زمان آسایش T1 می شود؛ باعث کاهش زمان آسایش T2 یا T2* نیز می شود و هرچه وزن سکانس در حال اجرا، T2* تر باشد؛ این تاثیر بیشتر است.
حال پس از انجام DSC Perfusion به کمک کنتراست دیفیوژنی و با سکانس GRE-EPI و رسم نمودار و استخراج پارامترها، تشخیص و تفسیر پزشک رادیولوژیست بر مبای همین متغیر ها و نقشه های رنگی مربوط به آنها انجام می پذیرد.
این تکنیک کاربردهای زیادی دارد که مهمترین آنها شامل افتراق عود از نکروز تومور، تشخیص مرکز سکته از ناحیه ی در معرض خطر (Penumbra) و کمک به تشخیص میزان بدخیمی نئوپلاسم بر اساس پاسخ همودینامیک توده است.
در بررسی Penumbra در سکته، از کنتراست دیفیوژن در کنار تکنیک پرفیوژن کمک گرفته می شود و هرآنچه از ضایعه را که در دیفیوژن مشاهده میکینم مربوط به مرکز از بین رفته در سکته است و اگر mismatch آن ناحیه در پرفیوژن دیده شود، هر آنچه از آناتومی که عدم انطباق دارد؛ Penumbra است یعنی هنوز زنده است ولی در معرض خطر است (شکل ۵ ).
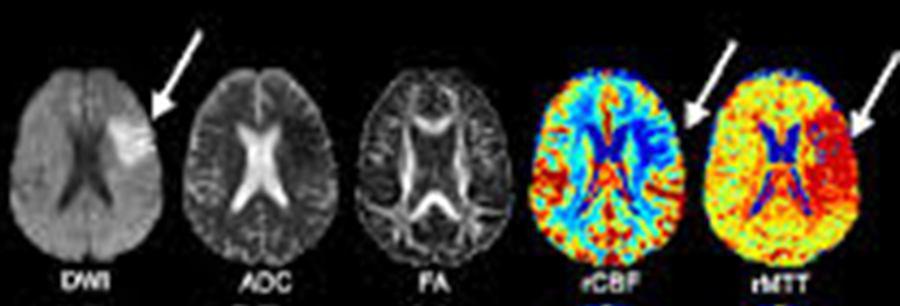 بررسی penumbra در سکته با پرفیوژن و دیفیوژن
بررسی penumbra در سکته با پرفیوژن و دیفیوژن
در بررسی درجه ی بدخیمی تومورها، هرچه CBF و CBV بالا رود و MTT و TTP کم شود؛ به نفع ضایعات بدخیم و رگ زا است. به عبارتی هرچه نمودار TIC عمیق تر و تیز تز باشد؛ احتمال Malignancy یا بدخیمی بالا می رود (شکل ۶).
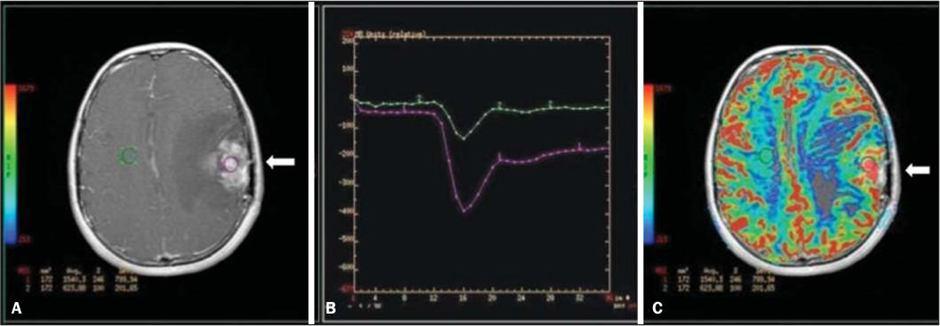 شکل ۶٫ تفاوت نمودار TIC در پرفیوژن در نئوپلاسم مغزی
شکل ۶٫ تفاوت نمودار TIC در پرفیوژن در نئوپلاسم مغزی
از دیگر کاربردهای کنتراست دیفیوژنی، تکنیک تخصصی DTI یا ترکتوگرافی است. این تکنیک هم به کمک سکانس GRE-EPI انجام می شود و در آن، رشته های عصبی مغز به تصویر کشیده می شوند.
بیشتر، در مبحث کنتراست دیفیوژنی به این نکته اشاره شد که این کنتراست با اضافه کردن یک جفت گرادیان دوقطبی به یک سکانس با پایه T2 یا T2* و با محاسبه ی میزان انتشار مولکولهای آب در حد فاصل بین اعمال ایندو لوب، بدست می آید.
اما این اعداد بدست آمده در هر سه راستا در کنتراست دیفیوژن، صرفا دارای بزرگی یا مقدار هستند (برای مثال، ۲۵ واحد اختلاف فاز به دلیل انتشار) و اصطلاحا اسکالر هستند. حال اگر به این اعداد، علاوه بر مقدار انتشار، جهت انتشار یا Orientation نیز اضافه شود؛ آنگاه دیگر کمیت اسکالر نیستند بلکه برداری هستند. (برای مثال، ۲۵ واحد اختلاف فاز در جهت راست به چپ یا چپ به راست به دلیل انتشار)
اگر انتشار مولکولهای آب یک بافت در تمام جهات برابر باشد اصطلاحا دارای انتشار یا دیفیوژن ایزوتروپیک است (همانند انتشار یک قطره جوهر در یک کاسه آب خالص) ولی معمولا در بافتهای بدن به ویژه در نورونهای مغز، به دلیل شکل خاص اناتومیک نورون، جهت انتشار در یک راستا (طول نورون) بر بقیه جهات و راستاها غالب تر است که این نوع انتشار اصطلاحا، آنیزوتروپیک نام دارد.
پس با این حساب، علاوه بر سه عدد اصلی بزرگی انتشار، نیاز به سه عدد فرعی برای نمایش جهت در هر سه راستا، (راستاهای چپ به راست – بالا به پایین و قدام به خلف) هست. پس اگر کنتراست دیفیوژن (GRE-EPI) را قادر کنیم که ۶ عدد انتشار را به ازای هر وکسل به دست آورد؛ می توان تصویر سه بعدی و فضایی انتشار در داخل هر وکسل (تنسور) را ترسیم کرد. تنسور در علم ریاضی با یک ماتریس ۳x3 نمایش داده می شود و منظور از آن، همان شکل سه بعدی و فضایی و جهت دار بیضی شکلِ انتشار است.
به سه عدد اصلی این ماتریس، عناصر قطری میگویند که همان اعداد اسکالر هستند و با Dxx, Dyy, Dzz نشان داده می شوند که هر کدام از این اعداد با فعال شدن تنها یک گرادیان به دست می آیند (شکل ۵ ). و به سه عدد فرعی این ماتریس، عناصر غیر قطری میگویند که همان اعداد برداری و جهت دار اند که از ترکیب دو گرادیان به صورت همزمان به دست می آیند (شکل ۷). (Dxy, Dxz, Dyz) D= Diffusion
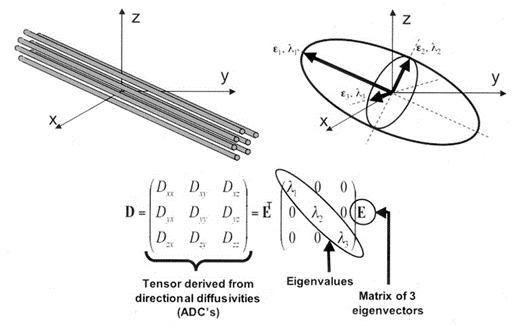 شکل ۷٫ تنسور و شکل فضایی آن در نورون
شکل ۷٫ تنسور و شکل فضایی آن در نورون
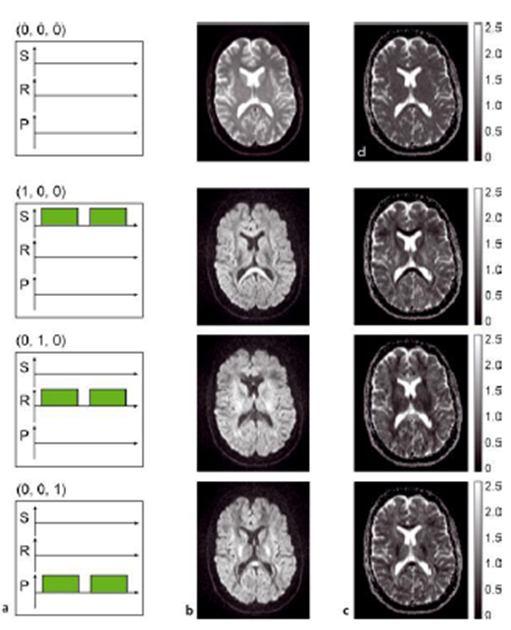 اعداد اصلی دیفیوژنی در DTI
اعداد اصلی دیفیوژنی در DTI
حال با داشتن ۶ مقدار دیفیوژنی بعلاوه ی یک مقدار صفر (همان تصویر T2*w GRE b value=0) یعنی با هفت عدد، توانستیم تنسور بیضی شکل داخل هر وکسل را به صورت رنگی ترسیم کنیم (شکل ۸).
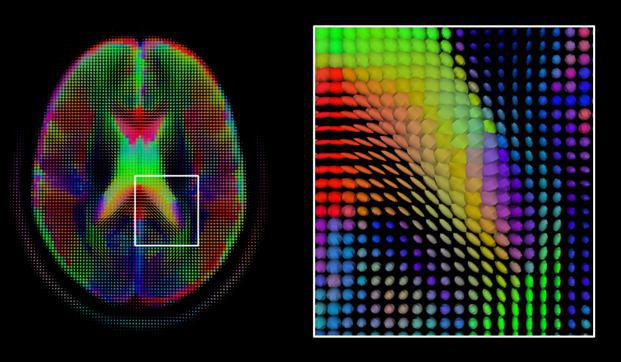 شکل ۸٫ تنسور رنگی داخل هر وکسل که معرف جهت و مسیر رشته ی عصبی مغزی است.
شکل ۸٫ تنسور رنگی داخل هر وکسل که معرف جهت و مسیر رشته ی عصبی مغزی است.
حال اگر با الگوریتمی خاص، این بیضیها که نمایانگر نورون عصبی هستند را به هم وصل کنیم؛ یک تراکت عصبی ترسیم می شود (شکل۹).
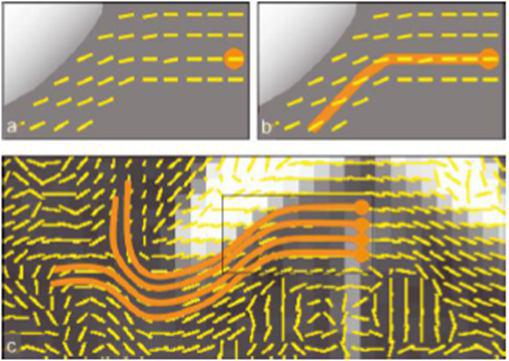 شکل ۹٫ الگوریتم نمایش رشته ی عصبی
شکل ۹٫ الگوریتم نمایش رشته ی عصبی
برای نمایش بهتر مسیر این رشته ها، جهات مختلف را با رنگهای مختلف نشان می دهند و به صورت سه بعدی نمایش می دهند. (شکل ۱۰ و ۱۱)
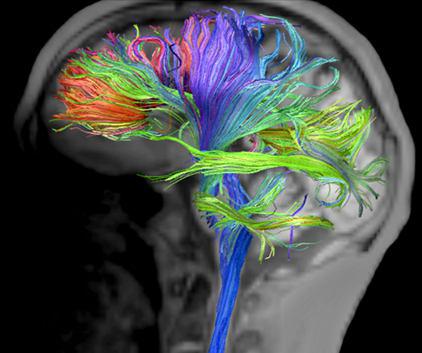 شکل ۱۰٫ ۳D DTI
شکل ۱۰٫ ۳D DTI
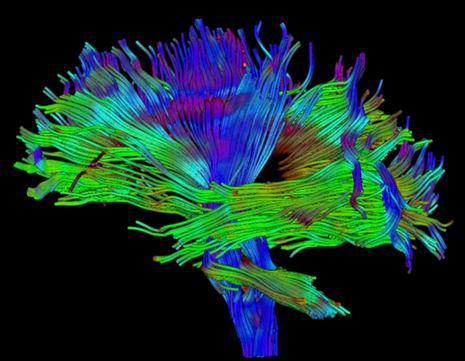 شکل ۱۱٫ ۳D DTI
شکل ۱۱٫ ۳D DTI
برای بهینه سازی این تکنیک، بهتر است وکسل مربعی باشد ( ۲ الی ۳ میلیمتر) و مقدار b value بین ۸۰۰-۱۴۰۰ S/mm2 باشد. و برای جلوگیری از عدم نمایش برخی “رشته های متقاطع” در یک وکسل، بهتر است تعداد اندازه گیری ها بالاتر رود (مانند روش Diffusion Spectrum Imaging (DSI)) و تکنیک Q ball Imaging و HARDI (شکل ۱۲ تصویر d)
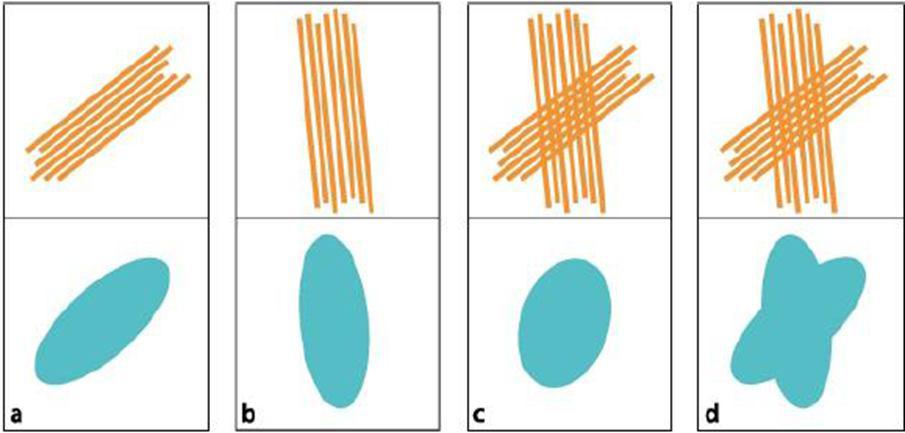 فیبرهای متقاطع در یک وکسل
فیبرهای متقاطع در یک وکسل
تکنیک DTI کاربردهای مهمی از جمله نمایش میزان درگیری و تخریب رشته های عصبی به واسه ی ضایعات فضاگیر و کمک به برنامه ریزی دقیقتر درمان و نوع جراحی تومور مغز توسط جراح دارد. اینکه تصمیم بگیرد از کدام ناحیه کرانیوتومی انجام دهد و یا اینکه به دلیل درگیری زیاد تومور با ضایعه فضاگیر، اصلا برنامه ی جراحی کنسل شود و به کمک روشهای مکمل مثل رادیوتراپی یا کموتراپی و یا تلفیقی از این سه روش، بیمار درمان شود. (شکل۱۳)
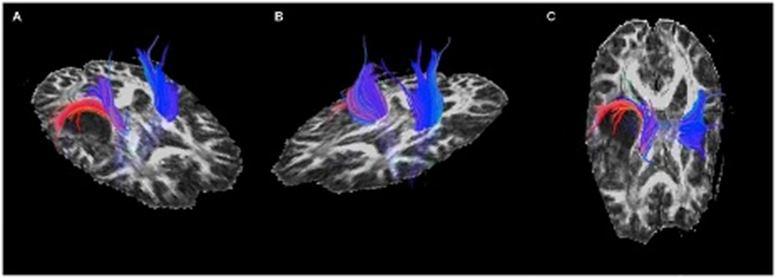 شکل ۱۳٫ تصویر DTI در بیمار مبتلا به تومور مغزی که رشته های عصبی را قطع کرده
شکل ۱۳٫ تصویر DTI در بیمار مبتلا به تومور مغزی که رشته های عصبی را قطع کرده
بحث آخر این ارائه، در باب تکنیک تخصصی fMRI هست که باز هم به واسطه ی کنتراست دیفیوژنی و به کمک سکانس GRE-EPI به دست می آید.
این تکنیک بر پایه ی تغییرات سطح اکسیژن خون در مغز طراحی شده است که اصطلاحا BOLD یا Blood Oxygenation Level-Dependent نام دارد. (شکل ۱۴)
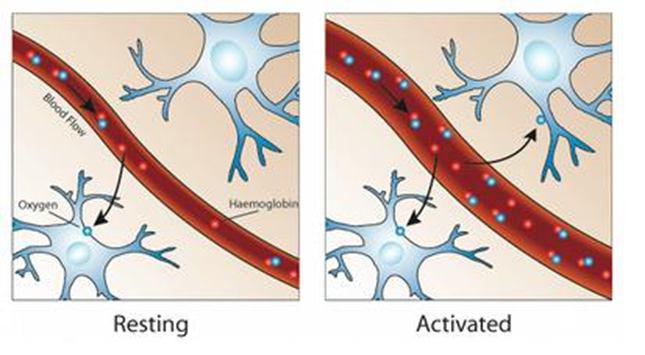 شکل ۱۴٫ مکانسیم BOLD fMRI
شکل ۱۴٫ مکانسیم BOLD fMRI
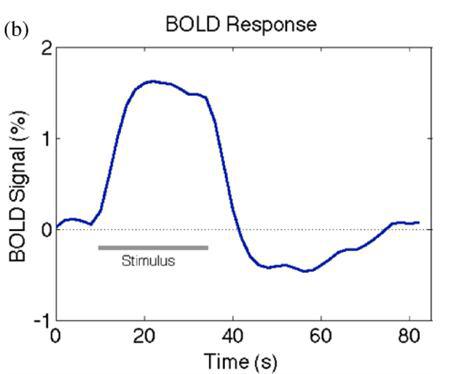 نمودار شکل ۱۵ که نمودار پاسخ همودینامیک در fMR
نمودار شکل ۱۵ که نمودار پاسخ همودینامیک در fMR
همانطور که شکل شماره ۱۴ و نمودار شکل ۱۵ که نمودار پاسخ همودینامیک در fMR هست؛ نشان می دهد؛ با فعالیت نورونهای مغزی، اکسیژن مصرف می شود و ترکیب اکسی هموگلوبین موجود در خون (Oxyhemoglobin) که یک ترکیب دیامغناطیس است و روی میدان مغناطیس تاثیر منفی ندارد؛ اکسیژن خود را از دست داده و تبدیل به ترکیبی جدید به نام دِ آکسی هموگلوبین (De-oxyhemoglobin) شده که این ترکیب، پارامغناطیس هست و باعث دفازه شدن و کاهش دامنه ی سیگنال دریافتی می شود. در ادامه، با ارسال پیام عصبی از مغز به قلب، حجم خون وارده به ناحیه دارای فعالیت در مغز بیشتر از حد نیاز شده و مجددا غلظت ترکیب دیامغناطیس در ناحیه ی فعال افزایش یافته و بنابراین دامنه ی سیگنال دریافتی مجددا افزایش می یابد.
این اختلاف دامنه ی سیگنال دریافتی در هنگام فعالیت (task) و استراحت (Rest) در مغز، حدود ۳ تا ۷% است و گرچه این عدد خیلی قابل توجه نیست اما با تکرار این آزمون (همانند تکنیک پرفیوژن) در حدود ۱۲۰ بار، این عدد مفهوم معناداری پیدا میکند و همانند تکنیک پرفیوژن، فیزیولوژی مغز را به تصویر میکشد.
برای درک بهتر از محل و آناتومی این ناحیه ی فیزیولوژیک فعال در مغز، نقشه ی fMRI بر روی تصاویر آناتومیک و حجمی و با رزولوشن بالای سکانس MP-RAGE / Turbo FLASH که کنتراست T1 دارد؛ ثبت می شود (شکل ۱۶)
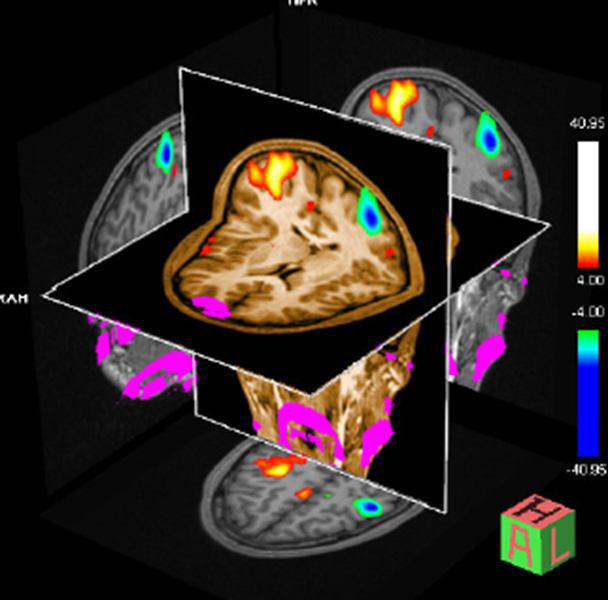 شکل ۱۶٫ تصویر نقشه ی fMR ثبت شده بر روی تصاویر با وزن T1 در سکانس ۳D MPRAGE
شکل ۱۶٫ تصویر نقشه ی fMR ثبت شده بر روی تصاویر با وزن T1 در سکانس ۳D MPRAGE
برای بهینه سازی و آنالیز دقیق تر و حذف آرتیفکتهای احتمالی از جمله حرکت و ثبت نابجا تصاویر fMRI ، این تصاویر طی هفت مرحله آنالیز می شوند (شامل تصحیح زمانی برش یا Slice timing correction – سوگیری مجدد فضایی – (Realignment) باهم ثبت کردن فضایی (Spatial coregistration) – استانداردسازی فضایی normalization Spatial – معرفی فضای Tolairaech و انتقال به فضای Tolairaech – نرم سازی فضایی spatial smoothing – آنالیز آماری Statistical Analysis) که در ارائه های قبلی توسط آقای توکلی به طور مفصل بیان شده اند.
تکنیک فانکشنال MR به دو روش Block Design و Event Related انجام می شود. در روش Block Design که شایعتر هست و دارای SNR و آنالیز آماری و زمان اسکن بالاتری است؛ بیمار در حین اسکن یک فعالیت را چندین بار تکرار میکند که در اصطلاح، بیمار در هر Paradigm (مجموع Task و Rest) یک عملکرد واحد را انجام میدهد. (بطور مثال حرکت انگشتان دست) اما در روش Event Related بیمار در هر Paradigm یک Task یا فعالیت خاص و متفاوت را انجام میدهد (مثلا در Paradigm
اول حرکت انگشتان و در Paradigm دوم پلک زدن و ….) این روش به علت امکان بررسی Task های مختلف در یک آزمون، در مجموع دارای زمان کمتری است ولی SNR و آنالیز آماری هم پایین است (شکل ۱۷).
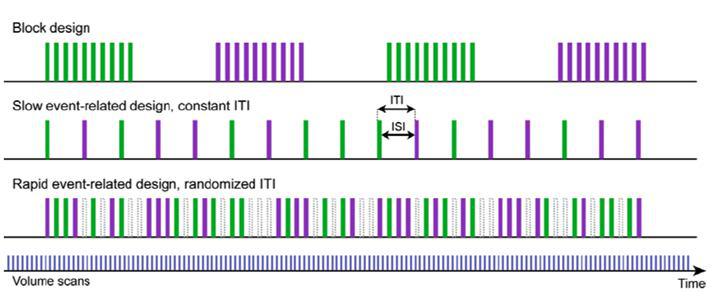 شکل ۱۷٫ دو روش Block Design و Event Related
شکل ۱۷٫ دو روش Block Design و Event Related
تکنیک تخصصی fMRI هم دارای کاربردهای متعددی در حوزه CNS است که مهمترین کاربرد آن، بررسی ارتباط اندامهای بدن با قسمتهای ۴۴ گانه مغزی است و اینکه هر عضوی از کدام قسمت در مغز دستور فعالیت می گیرد.
این تکنیک هم که همانند DSC پرفیوژن و ترکتوگرافی به کمک کنتراست دیفیوژنی ایجاد می شود؛ می تواند در تعیین برنامه جراحی تومورهای مغزی در کنار ترکتوگرافی بسیار کارامد باشد و بینشی وسیع قبل از جراحی، از حساسیت و اهمیت عملکردی آناتومی اطراف تومور به جراح مغز و اعصاب بدهد (شکل ۱۸).
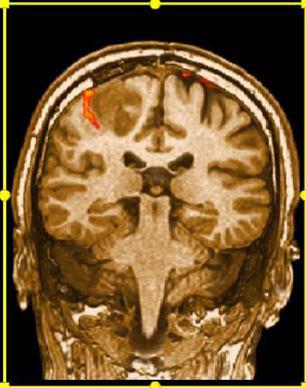
 شکل ۱۷٫ تصاویر fMR در بیمار مبتلا به تومور مغزی با Task دست راست
شکل ۱۷٫ تصاویر fMR در بیمار مبتلا به تومور مغزی با Task دست راست
منبع: گروه تلگرام Optimizing MRI Sequences
تهیه کننده : جناب آقای عبدالمحمدی





با سلام و عرض احترام:
مطالب شما استاد بسیار ارزشمند ودر خور ستایش بود .تشکر بیکران .منتظر مطالب بیشتری از شما هستیم
واقعا ممنونم…خیلی جامع و کامل بود.شما منابعی در مورد کنترل کیفی دیفیوژن میشناسید؟
به زودی وارد این مباحث هم خواهیم شد منتظر باشید. ممنون از توجهتون.
سلام،بسیارعالی بود،مدتها دنبال یک مقاله یاکتاب جامع دربارهDWIبودم،بسیارعالی توضیح داده شده،موفقیت روزافزون شمارا ازخداوند خواهانم،