پرفیوژن عروقی فرآیندی است که طی آن گلوکز و اکسیژن مورد نیاز مغز توسط سیستم گردش خون و مویرگ ها به سلول های عصبی منتقل می شود. اختلال در پرفیوژن، تقریباَ در تمامی بیماری های مغزی مانند سکته قطعی ، تخریب نورونی و نئوپلاسم ها رخ می دهد.
تصویربرداری جریان خون به عنوان روشی تشخیصی و کلینیکی به کار می رود. با استفاده از H2O15 در روش توموگرافی گسیل پوزیترون و استفاده از ردیابهای قابل انتشار، میتوان به محاسبه تغییرات جریان خون پرداخت
PET به عنوان یک استاندارد مهم برای انجام مطالعات پرفیوژنی استفاده می شود ولی باید در نظر داشت که استفاده از ردیابهای رادیواکتیو هم گران میباشد و هم دوز اشعه دریافتی بیمار را بالا می برد در نتیجه محدودیتهایی برای استفاده از این مواد هم برای بیماران و هم برای کادر درمان ، وجود دارد.
تصویربرداری پرفیوژنی تشدید مغناطیسی برای ارزیابی پرفیوژن مغز در موارد زیادی مانند سکته های حاد مغزی، تومورهای مغز و بیماری های تخریب نورونی به کار می رود
برخلاف آنژیوگرافی که به مشخص کردن جریان در عروق بزرگ می پردازد، روش MR PWI به نشت خون از مویرگ ها و بستر مویرگی ، حساس است. اندازه گیری پرفیوژن بافت به توانایی ثبت مداوم و سریع تغییرات غلظت ردیابها، در بافت هدف بستگی دارد.
روش¬های تصویربرداری بر وزن پرفیوژنی
.
به صورت کلی PWI را به دو روش اساسی می¬توان انجام داد:
– روش نشانه¬گذاری اسپین شریانی (ASL)
– تصویربرداری دینامیک ( با کنتراست پذیرفتاری مغناطیسی (DSC) و بر پایه افزایش کنتراست به روش (DCE)
روشهای PWI به صورت دینامیک بر پایه کنتراست تغییرات پذیرفتاری مغناطیسی (DSC)و یا بر پایه افزایش کنتراست به روش DCE) , از روش¬های بسیار شایع ارزیابی تغییرات همودینامیکی در موارد سکته های حاد مغزی، تروما، تصویربرداری تومورها و موارد تحقیقاتی می باشند. این تکنیکها بر پایه عبور داروی کنتراست از عروق شریانی و بستر مویرگی و تغییرات سیگنال به وجود آمده درحین عبور بولوس دارو است .
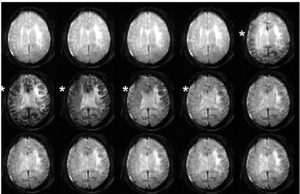
سری تصاویر آکسیال از مغز بر وزن T2* که همزمان با عبور بولوس کنتراست زا گرفته شده است. رسیدن دارو باعث ایجاد تضعیف سیگنال در تصاویر می شود(*).?????
تحت شرایط عادی پرفیوژن در شرایطی که سد خونی مغزی BBB تخریب نشده باشد، داروی کنتراست در لومن عروق و شبکه مویرگی باقی می ماند و به فضای خارج عروقی نشت نمیکند. در هنگام عبور داروی کنتراست در عروق، یک حجمه کوچک از دارو باعث ایجاد غیریکنواختی در میدان مغناطیسی می شود که سبب کاهش زمان آسایش بردار عرضی در بافت می گردد. این غیریکنواختی در میدان مغناطیسی توسط وزن هایT2 و T2* در سکانس های اسپین اکو و گرادیان اکو ثبت می شود.
نحوه گرفتن تصاویر پرفیوژن:
برای گرفتن تصاویر بر وزن پرفیوژن، داروی کنتراست¬ باید به سرعت تزریق شود تا اطمینان از ترکیب صحیح دارو با حجم خون و به وجود آمدن حداکثر تغییرات سیگنال بعد از رسیدن آن بولوس به ناحیه مورد نظر، حاصل شود. برای این منظور باید یک برانول شماره ۱۸ یا حتی ۱۶ برای بیمار تعبیه شود و تزریق توسط یک انژکتور قدرتمند و سازگار با شرایط MRI که قدرت تزریق تا ۵ml/s را داشته باشد با دوز داروی ۰٫۲mmol/kg (یا کمتر در دستگاه های ۳ تسلا) صورت بگیرد.
سکانس های تصویربرداری باید تا حد ممکن سریع باشند تا اجازه اندازه گیری تغییرات سریع و جزئی ناشی از ورود بولوس به ناحیه مورد نظر را به ما بدهند. همچنین باید رزلوشن زمانی بالایی داشته باشند (برای مغز کمتر از ۲ ثانیه). بهترین سکانسهایی که برای این منظور استفاده می شوند GRE T2* single shot- EPI و T2W SE- EPI می باشند
سکانس های SE-EPI تصاویر بسیار حساس و خوبی را از اثرات تغییر پذیرفتاری مغناطیسی که حتی توسط مویرگ های بسیار ریز ۵ میکرومتری نیز به وجود می آید، ثبت می کنند. سکانس های GE-EPI برای عروق بزرگتر (>7 میکرومتر) حساسیت بهتری دارند. به همین دلیل سکانس های SE-EPI حساسیت ذاتی بیشتری را در مقایسه با GE-EPI برای بررسی عروق در مقیاس میکرومتری، نشان می دهند.
در مطالعات کلینیکی از سکانسهای GE-EPI استفاده بیشتری می شود. این سکانس ها به دلیل حساسیت بالایشان به تغییرات اثر پذیرفتاری مغناطیسی و کاهش سیگنال که با عبور بولوس کنتراست از ناحیه مورد نظر به وجود می آید، حساسیت بیشتری دارند بنابراین نیازمند دوز کمتری از ماده کنتراست می باشند. این خاصیت نه تنها برای عروق ریز، بلکه برای عروق بزرگتر و سیاهرگ های سطح مغز نیز کاربرد دارد
یک جایگزین برای سکانس های T2 و T2* استفاده از سکانس های T1W(افزایش سیگنال) است که به آسایش حساستر از اثرات پذیرفتاری ( کاهش سیگنال) می باشند. به دلیل اینکه اثر آسایش قویتر از اثر پذیرفتاری مغناطیسی است، تصاویر با کنتراست T1W نیاز به داروی کنتراست کمتری دارند (حدوداَ ۱۰%) و اجازه تکرار مطالعه را به ما می دهند.
یکی دیگر از دلیل های استفاده از سکانس های T1W اینست که در آنها تخریب سد خونی مغزی بهتر از تصاویر T2 و T2*، به تصویر کشیده می شود. کاهشی که در نتیجه عبور شلات کنتراست به وجود می آید، اجازه رسم نمودار شدت سیگنال نسبت به زمان را در یک وکسل خاص یا یک ناحیه مورد مطالعه ROI را به عنوان یک عملکرد از زمان، به ما می دهد
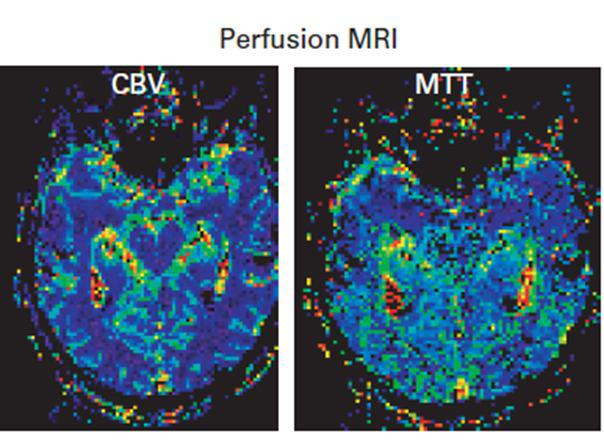
. این نمودار میتواند به نمودار غلظت دارو نسبت به زمان نیز تبدیل شود. مقادیر تمامی نمودارهای غلظت به زمان در تمامی وکسل ها همراه با نقشه های پرفیوژنی و تغییرات همودینامیکی آنها می تواند محاسبه شود و میزانCBF و CBV و MTT و TTP را برای آنها به دست آورد.
. این پارامترها وابسته به گزینه ها و خصوصیات مربوط به تزریق دارو مانند سرعت تزریق، میزان و غلظت آن هستند و برای بیماران گوناگون، متناسب با حجم عروق بدن و میزان برون ده قلبی، متفاوتند. درنتیجه پارامترهای همودینامیکی نمی توانند به درستی بین افراد مختلف و در موارد گوناگون و زمان ها و آزمایشات مختلف، یکسان باشند.
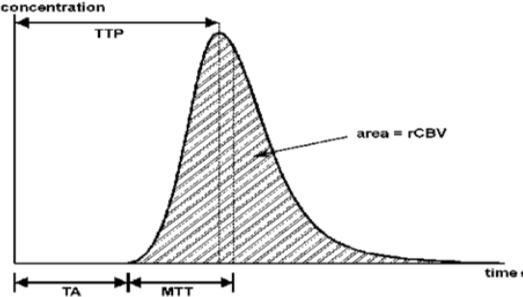
نمودار غلظت نسبت به زمان ???
اکنون به تعریف پارامتر های مورد بررسی در تصاویر پرفیوژن می پردازیم
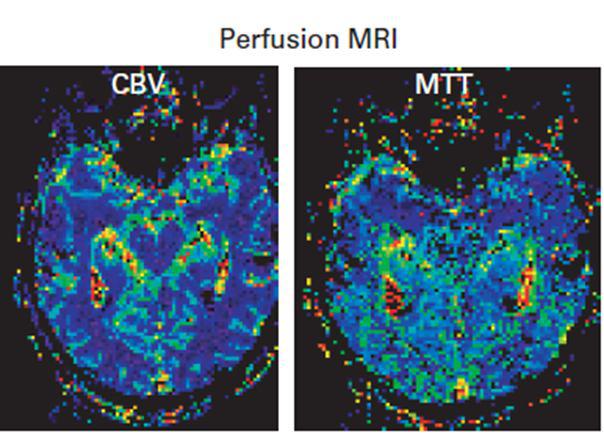
حجم خون مغزیCBV قسمتی از هر وکسل تصویربرداری شده در مقایسه با فضای بین عروقی است و در نتیجه حجم عروق خونی را نسبت به حجم بافت مغزی می سنجد و واحد آن یک میلی لیتر خون در ۱۰۰ گرم از بافت می باشد و چون دانسیته بافت مغز نزدیک به دانسیته آب است، برای مغز ۱g/milliliters محاسبه می شود ولی به عنوان درصد بیان می شود. به طور روتین مقدار آن برای مغز حدود ۳ تا ۵ درصد است تنها مقدار کمی از CBV متعلق به خون مویرگها و وریدها است و تغییرات آن وابسته به تغییرات اتوماتیکی عروق و گشادشدگی آنها می باشد.
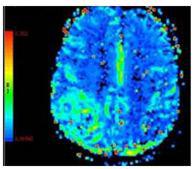
حجم خون نسبی مغز rCBVبه عنوان ناحیۀ زیر منحنی غلظت نسبت به زمان تعریف می شود
-در CBV مطلق ،با تعیین یک وکسل مرجع(AIF) که ۱۰۰% حاوی خون باشد مانند ناحیه سینوس ساجیتال فوقانی، اندازه گیری شود
جریان خون مغزی CBFبه میزانی از خون شریانی گفته می شود که در واحد زمان به بافت مغز می رسد و به صورت میلی لیتر خون بر ۱۰۰ گرم از بافت در دقیقه بیان می شود.
مقادیر اختصاصی برای ماده خاکستری ۶۰ml/min/100gr و برای ماده سفید ۱۵ml/min/100gr است.جریان خون مغزی توسط عواملی که مسئول تغذیه شریانچه های مغز هستند، کنترل می شوند.CBF به عنوان فاکتور اصلی که باعث رساندن مواد مغذی به سلول های عصبی و دور کردن مواد زائد از آنهاست، می باشد و میزان کمتر از حد آستانه آن میتواند نشان دهنده وجود اینفارکت در ناحیه مورد نظر باشد
میانگین زمان عبور MTT به بررسی میانگین زمان عبور حجم خون از بستر مویرگی در ناحیه مورد نظر می پردازد.
. بستر مویرگی از تعداد بیشماری مویرگ با ابعاد مختلف و طول های نا مشخص تشکیل شده است در نتیجه زمانی که خون صرف عبور از بافت می کند متفاوت می باشد. واحد شمارش آن ثانیه است. مقادیر ثبت شده برای MTT در بافت نرمال مغز حدود ۳ تا ۵ ثانیه است که در موارد سکته حاد مغزی، این زمان افزایش می یابد.
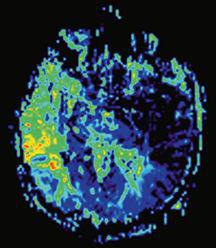
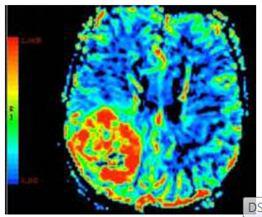
در تصاویر MTT افزایش زمان عبور در نواحی را با رنگ های گرم قرمز و به تدریج زرد و سبز می توانید مشاهده کنید
هر دو سری تصاویر CBV , MTT مربوط به نواحی دچار نقص خونرسانی شده در بیمار مبتلا به سکته مغزی حاد می باشند.
با توجه به اصول گفته شده می¬توان رابطه نزدیکی را بین CBF , CBV , MTT به دست آورد
CBF=CBV/MTT
زمان رسیدن به حداکثر غلظت TTPبه عنوان زمان رسیدن حداکثر غلظت داروی کنتراست بعد از شروع تزریق به ناحیه مورد نظر و ایجاد حداکثر کاهش سیگنال در آن ناحیه، به صورت ثانیه بیان می شود و هرگونه تأخیر در رسیدن دارو و نحوه تزریق سریع دارو در آن مؤثر است
در روش تصویربرداری دینامیک با کنتراست پذیرفتاری مغناطیسی (DSC) ترکیب مبتنی بر Gd به عنوان یک عامل کنتراست T2* در حین اولین عبور آن از میان عروق مغز عمل نماید. این عامل کنتراست سبب یک کاهش گذرا در شدت سیگنال ( اثر کوتاه شدگی T2* )، متناسب با غلظت در یک ناحیه مشخص می شود. این روش اصطلاحاَ. با استفاده از یک سکانس پالسی سریع )غالباَ (EPI ، ۵۰ تصویر متوالی در حین تزریق کنتراست در مدت زمان تقریبی ۷۰ ثانیه تا ۲ دقیقه ، به دست می آید
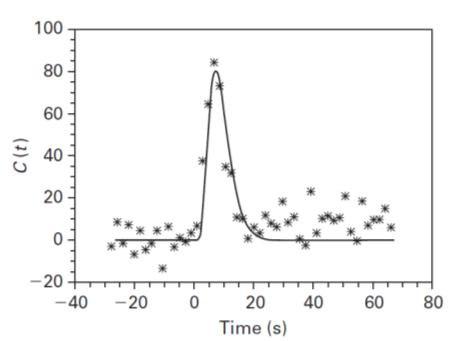
میزان غلظت دارو بر حسب زمان در سکانس T2* در بافت طبیعی مغز.???
یافته های استاندارد برای تصویربرداری DSC در مغز با استفاده از سکانس های T2 و T2* و تصاویری با قدرت تفکیک فضایی بالا در مدت هر ۵/۱ الی ۲ ثانیه ، در هنگام تزریق بولوس کنتراست یا بعد از آن می باشد.
. همانطور که در شکل مشاهده می کنید شدّت سیگنال در بافت با ورود ماده کنتراست کاهش پیدا می کند و این به دلیل اثر کاهش T2* در بافت، همراه با حضور کنتراست در عروق است. ابتدا شدت سیگنال به طور شدید کاهش پیدا می کند و سپس شروع به افزایش و برگشتن به حالت پایه می کند زیرا جریان خون به طور طبیعی دارو را از محل مورد نظر می برد.شکل نمودار در موارد پاتولوژی تغییر می کندو بسته به تغییرات عروقی می تواند متفاوت باشد
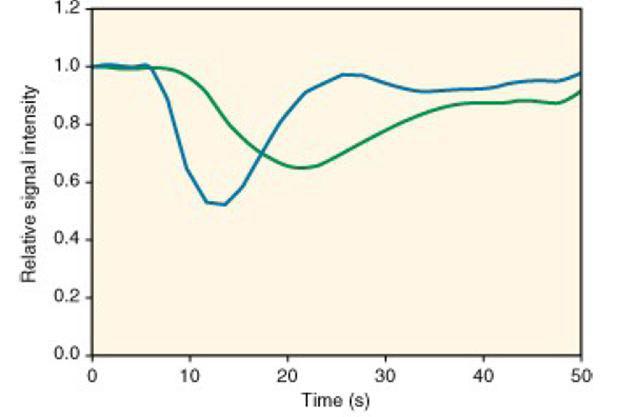
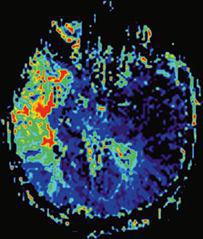
کاهش سیگنال در ناحیه مورد مطالعه بدون اثر (آبی) و با اثر (سبز) نواقص پاتولوژیک ناشی از سکته مغز در حین عبور بولوس کنتراست?
همانطور که دیدیم استفاده از DSC-MRI به ما اجازه می¬دهد پارامترهایی مانند CBV درباره فرآیند عروقی اندازه گیری کنیم. اندازه¬گیری میزان نفوذپذیری غشای اندوتلیال، اندازه سطح غشا وفضای میان بافتیEES نیازمند آنالیزهای کمّی درباره نشت کنتراست از فضای عروق به فضای میان بافتی است.
استفاده از تصاویر T2 یا T2* برای بررسی مقادیر نشت دارو به فضای EES به دلایلی مشکل است و اگرچه بعضی از تکنیک¬ها به بررسی آن پرداخته¬اند ولی آنها نیز متأثر از مشکلات تغییرات غیر خطی سیگنال و تغییرات پذیرفتاری مغناطیسی و آسایش بافتی هستند.
به همین دلایل استفاده از تصاویر T1 برای جمع¬آوری داده های عروقی با ماده کنتراست بسیار متداول است. با استفاده از این تصاویر می¬توان به بررسی میزان غلظت دارو و آنالیز داده¬ها با مدلهای استاندارد پرداخت
در هنگام تزریق بولوس کنتراست، تعیین میزان دقیق حجم داروی کنتراست در عبور اولیه از ناحیه مورد بررسی، نیازمند قدرت تفکیک زمانی بالا ، معمولاً ۵ ثانیه یا کمتر است. این زمان کم، باعث خراب شدن قدرت تفکیک فضایی تصویر، به دلیل کم بودن زمان اسکن می¬شود. بسیاری از مراکز از سکانس¬های گرادیان اکوsingle shot استفاده می¬کنند. با دستگاه¬های امروزی می¬توان تصاویری با ماتریس ۲۵۶×۲۵۶×۲۵۶ را در ۵ ثانیه به دست آورد.
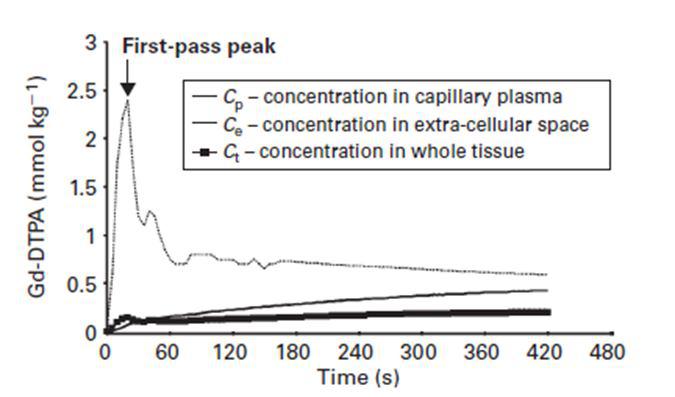
??? نمودار غلظت دارو در بستر مویرگی تومور،در فضای خارج مویرگی و در حجم مورد بررسی در واحد زمان
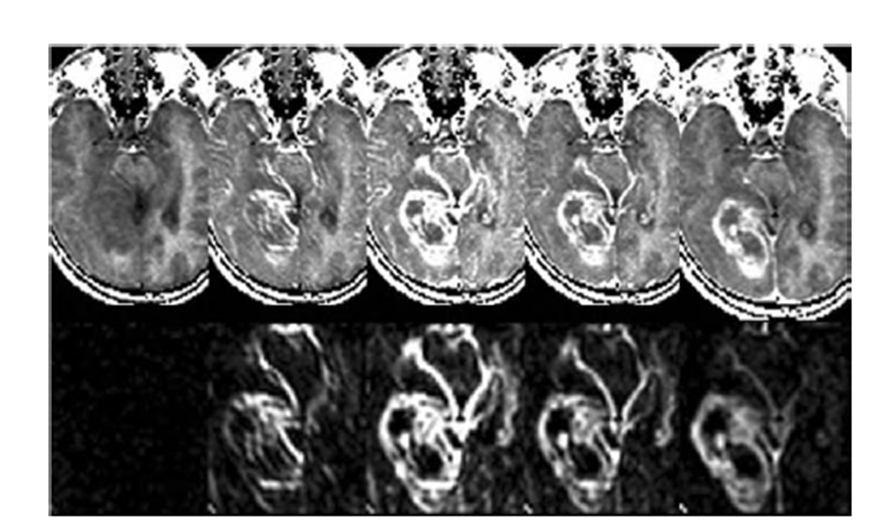
تصاویر DCEدر بیماران با تومور گلیوم (ردیف بالا)، نقشه محاسبه شده غلظت دارو (در پایین)???
رابطه بین تغییرات سیگنال با غلظت دارو به صورت غیرخطی است و به میزان T1 بافت زمینه در هر وکسل بستگی دارد. بنابراین نیاز است که یک سری تصاویر T1W را قبل از تزریق داروی کنتراست از حجم مورد نظر داشته باشیم و این می¬تواند در زمان پردازش تصاویر صرفه جویی کند
۱-۲- آرتیفکتها و موارد خطای موجوددر تصویر برداری پرفیوژن
کنتراست ناشناخته
اگرچه رابطه ای بین میزان غلظت داروی کنتراست و تغییرات ایجاد شده در سرعت آسایش، وجود دارد ولی مطالعات نشان داده اند که بر اساس نوع داروی کنتراست و نوع عروق و بافت زمینه می تواند مقادیر CBF متفاوت باشد. محققان با مطالعه بر روی داوطلبان نرمال توانسته اند برای CBF مقادیر (ml / 100gr / min) را محاسبه کنند. ولی باز هم احتمال تغییر این مقادیر برای بیماران با پاتولوژی های مختلف وجود دارد
وقفه در عبور بولوس کنتراست از ناحیه مورد نظر باعث تخمین غلط مقادیر CBF می شود. این خطا ممکن است از ناحیه ای به ناحیه دیگر، متغیر باشد. بعضی روش های محاسباتی برای تعیین و تصحیح این خطاها وجود دارد.
. در DSCI از روشهای SVD استفاده میکنند و مشخص شده است که در مطالعات DSCI به طور روتین، وقفه در بولوس حدود ۱ الی ۲ ثانیه منجر به خطای تخمین کمunder estimation ، حدود ۴۰% در CBF و خطای تخمین زیاد upper estimation ، تا ۶۰% در میزان MTT می شود که این تأخیرها در بیمارانی با مشکلات عروقی در مغز بسیار شایع است
مخصوصاً در بیماران با سکته مغز یا بیمارانی که دارای نئوپلاسم و انسداد عروقی vessel occlusion یا جریان عروقی دوطرفه Collateral circulation هستند، این مورد شایعتر است. در این بیماران نقشه های پرفیوژن با در نظر گرفتن احتمال خطا در محاسبات، بررسی می شود.
اثرات حضور داروی کنتراست
اگرچه حداکثر شدت اثر داروی کنتراست در روش DSCI تنها چند دقیقه بعد از تزریق بولوس کنتراست مشاهده می شود ولی مطالعات نشان داده اند که تا ۲ ساعت بعد از تزریق ، اثر دارو در بافت اطراف عروق باقی میماند و در تزریق دوم، در سیگنال تصویر اثر خواهد گذاشت
. این اثر باقیمانده در زمانی که مطالعه با تزریق های متعددی همراه باشد، باید محاسبه شود. اگر این تغییرات سیگنالِ باقیمانده از اثر داروی کنتراست تزریق شده قبلی درنظر گرفته نشود، باعث تخمین بیش از اندازه در محاسبات و خطا در میزان سیگنال دریافتی خواهد شد
برای کاهش اثر داروی تزریقی قبلی میتوان دوز بسیار کمی از دارو را قبل از تزریق اول به بیمار داد و سپس پروتکل های اصلی را شروع کرد. در اینصورت از همان ابتدا سیگنالی خواهیم داشت که با سیگنال داروی باقیمانده ادغام شده است و محاسبات را تعدیل می¬کند
جابجایی وکسل ها
به دلیل قدرت تفکیک فضایی بالایی که برای تصاویر پرفیوژن در هنگام عبور بولوس کنتراست لازم است، بیشتر از سکانس¬های اکوپلنار استفاده می شود. سکانس EPI دارای آرتیفکت¬هایی است که باعث اختلال در محاسبات تصاویر برای رسم نقشه پرفیوژن می-شود. یکی از دلایل اصلی ایجاد آرتیفکت در این تصاویر، استفاده از تصاویر با پهنای باند کم به ازای هر پیکسلHZ / pixel ) (~10 در جهت کدگذاری فاز است که باعث تولید آرتیفکت¬های مانند آرتیفکت جابجایی شیمیایی و آرتیفکت پذیرفتاری مغناطیسی و بهم ریختگی ابعاد تصویر در مرز بین دو بافت، با خاصیت پذیرفتاری مغناطیسی متفاوت، می¬شود.
این آرتیفکت ها مخصوص تصاویر DSCI نیستند بلکه در سکانس های اکوپلنار دیده می شوند. به خاطر خصوصیات پارامگنتیکی دارویی کنتراست، بهم ریختگی میدان مغناطیسی در ناحیه مورد بررسی در هنگام عبور بولوس کنتراست، به وجود می آید و باعث اشتباه در تشخیص عروق و اختلال در زمان دریافت سیگنال در پیکسل های نزدیک مرز عروق می شود. این آرتیفکت ها باعث نشان دادن میزان CBV به صورت کاذب، نسبت به مقدار واقعی خود می شوند.
مخصوصاً در اولین عبور داروی کنتراست از ناحیه مورد نظر که غلظت دارو به دلیل حضور بولوس تزریقی، ماکزیمم است. بنابراین باید دقت شود هنگامی که از سکانس EPI استفاده می شود، سیگنال نزدیک به مرز عروق، تاحدودی آرتیفکت است و باید در نظر داشت که این آرتیفکت شامل مقادیر AIF اندازه گیری شده نیز میباشد و نواحی که برای اندازه گیری AIF انتخاب میشوند باید دور از دیواره عروق بزرگ باشند.
حرکت بیمار
حرکت بیمار نیز یکی از دلیل ایجاد آرتیفکت در تصاویر DSCI است. به دلیل اینکه در این تکنیک تزریق سریع داروی کنتراست صورت می گیرد، احتمال حرکت بیمار در هنگام تزریق بیشتر میشود
. بسته به میزان حرکت، احتمال تخریب داده ها و عدم توانایی دستگاه برای بازسازی داده ها به دست آمده بیشتر میشود.اگر حرکت (حتی اگر بسیار زیاد باشد) فقط در زمان تزریق بولوس صورت پذیرد، داده ها هنوز فابل استفاده هستند. به دلیل اینکه چند ثانیه ای طول می کشد تا داروی کنتراست به مغز بیمار برسد و داده هایی با کیفیت خوب، از عبور بولوس به دست می آید. ولی باید دقت شود که دیگر از داده های اولیه پیش از تزریق در پردازش داده ها استفاده نشود
اگرچه معمولاً از تصاویر اولیه پیش از تزریق استفاده می کنند تا بتوانند حرکات جزئی را تصحیح کنند; ولی این روش همیشه و برای تمامی حرکت ها مناسب نیست زیرا همیشه به دلیل قدرت تفکیک فضایی موجود، حداقل پوشش فضایی به دست می آید و به طور معمول فاصله زیادی بین هر اسلایس موجود است. در نتیجه فقط تصحیح حرکات داخل پلان اسلایس ممکن خواهد بود
تصویربرداری پرفیوزنی تشدید مغناطیسی برای ارزیابی پرفیوژن مغز در موارد زیادی مانند سکته های حاد مغزی، تومورهای مغز و بیماریهای تخریب نورونی به کار می رود
در مورد تومورهای مغزی، اندازه گیری پرفیوژن برای تعیین درجه تومور گلیوما، برای افتراق بین انواع تومور ها مانند تومور اولیه از متاستازها و تومور های ثانویه و لینفوماها، برای افتراق عود از نکروز بعد از رادیوتراپی و برای افتراق بین نئوپلاسمهای درجه بالا از ضایعات غیر نئوپلاسمی مانند آبسه ها ، استفاده می شود. همچنین تصویربرداری پرفیوژنی برای تشخیص بیماری هایی مانند آلزایمر، موارد شناختی مزمن ، صرع و ام اس نیز کاربرد دارد.
رگ زایی Angiogenesis
تمامی بافتهای نرمال یا پاتولوژیک برای به دست آوردن منابع انرژی یا دفع مواد زائد متابولیکی خود وابسته به منابع خونی و عوامل خونرسانی هستند. با رشد بافت، ساختارهای عروقی مناسب و متناسب با آن نیز توسعه پیدا می کنند که این فرآیند تحت عنوان رگ زایی بیان می شود
فرآیند عروق زایی بسیار پیچیده است و میتواند تحت تاثیر عوامل مختلفی قرار بگیرد. به طور کلی رشد بافت و در پی آن رشد عروق در نواحی خارج از مرزهای عروقی، تحت تاثیر آزاد شدن فاکتورهایی است که در پاسخ به کم شدن میزان اکسیژن و گلوکز در سلولها، تولید می شوند.
یکی از مهمترین این فاکتورها سیتوکینون فاکتور رشد عروقی Vascular Endothelial Growth Factor است که از مهمترین فاکتورهای مشترکی است که در بسیاری از موارد عروق زایی در بافت پاتولوژی دیده شده و در پاسخ به کمبود اکسیژن یا کمبود گلوکز در بافت در سلول ها آزاد میشود و باعث بهبود منابع تغذیه سلولی می شود
در بافت های پاتولوژیکی مراحل رگ زایی معمولاً غیر طبیعی است و منجر به پیدایش بستر عروقی غیر طبیعی ، با خصوصیات عروقی و مورفولوژیکی بیماری می شود . ناحیه مرکزی توموری که رشد سریعی دارد معمولاً جریان خون غیر طبیعی را داراست که میتواند به دلیل کاهش فشار پرفیوژن ناشی از طرح عروقی غیر طبیعی آن و افزایش فشار داخل عروقی تومور باشد .
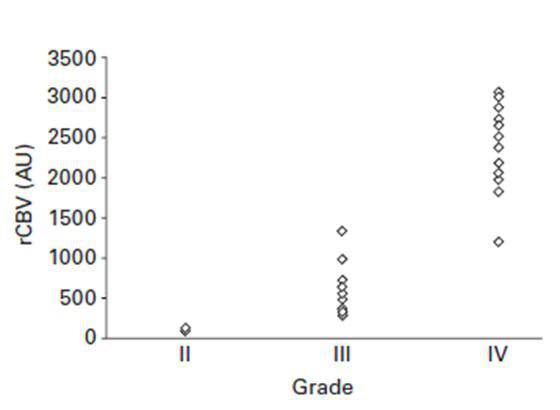
اسکنوگرام رابطه بین حجم خون و درجه گلیوما???
DSCI-MRI گلیوماها
مطالعات زیادی بر روی فرآیند عروق¬زایی تومورهای مغزی صورت گرفته ولی هیچکدام به عنوان یک روش روتین برای موارد کلینیکی مورداستفاده قرار نگرفته اند. نتایج قابل ملاحظه ای از این تحقیقات روی نوع تومور، تعیین درجه تومور و پاسخ به درمان آن به دست آمده است . در گلیوماها ، حجم خون مویرگی تومور به وسیله روش DSCI-MRI اندازه گیری می شود و می تواند در ارتباط با درجه تومور باشد
نقشه های بسیار مهم rCBV، نواحی بدخیم تومور را مشخص می کنند و اجازه می دهند که تخمین دقیقی از محل بیوپسی استریوتاکتیک در اختیار ما باشد و میتوانند پیش بینی درستی از درجه تومور را در اختیار ما قرار دهند
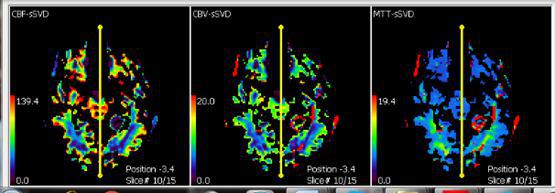
مقایسات هیستولوژیکی نشان داده که ارتباط دقیقی بین میزان r CBV تومور و ساختارها و فرآیندهای تهاجمی آن مانند فعالیت میتوزی سلولی و طرح عروقی و عروق زایی آن وجود دارد
همچنین از بررسی بین نقشه r CBV و دیگر روش های تصویربرداری مانند PET و FDG نتیجه گیری میشود که رابطه مستقیمی بین میزان بیشینه جذب گلوکز و rCBV وجود دارد.
انواع دیگر تومورها
بامقایسه مقادیر حجم خون مغزی در مورد تومورهای intra & extra axial نشان داده شده است که توده های extraaxial معمولاً از مقادیر حجم خون بیشتری برخوردار هستند این نکته می تواند برای افتراق بین تومورهای extra & intra axial مفید باشد. در حالیکه روشهای دیگر اختلاف چندانی را نشان نمیدهند.
همچنین اندازه گیری میزان جریان خون مغزی rCBV میتواند برای افتراق بین تومورهای مننژیوما ، شوآنوما، نورینوماها نیز کمک کننده باشد. مننژیوماها دارای مقادیر بالاتر rCBV نسبت به نورینوماها و شوآنوماها هستند.
به علاوه rCBV میتواند اطلاعات کلی درباره افتراق بین لینفومای بدخیم و گلیوما را در اختیار ما قرار بدهد زیرا نبود بستر عروقی و رشد عروقی فراوان در لینفومای بدخیم باعث کاهش میزان rCBV می شود که متضاد با چیزی است که درگلیومای بدخیم رخ می دهد
استروک:
تصویربرداری پرفیوژن به طور گسترده ای در تصویربرداری hyperacute و subacuteاستروک استفاده میشود انجام تصویربرداری پرفیوژنی توسط دستگاه مولتی دتکتور سی تی MDCT و یا انجام MR پرفیوژن می تواند برای تشخیص میزان acute stroke و نشان دادن ناحیه ایسکمیک و penumbra مورد استفاده قرار گیرد.
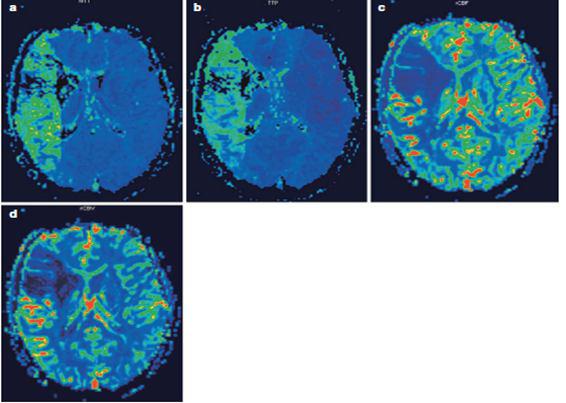
Parametric maps generated by perfusion-weighted imaging (PWI) in a patient with hyper acute right middle cerebral artery stroke .(a) Mean transit time (MTT) map. (b) Time to peak (TTP) map. (c) Regional cerebral blood flow (rCBF) map. (d) Regional cerebral blood volume (rCBV) map. The hypo perfused area corresponds to the distribution territory of the right middle cerebral artery.???
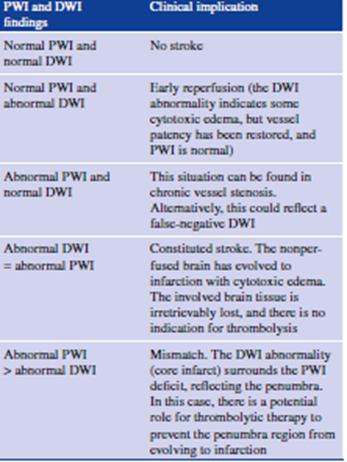
Mismatch DWI & PWI:
در بیمارانی با استروک حاد حجم ناحیه ایسکمیک که به وسیله PWI مشخص می شود معمولا بیشتر از ناحیه پارانشیمی آسیب دیده است که به وسیله DWI مشخص می شود. در اینگونه بیماران تزریق داخل وریدی recombinant plasminogen activator r-(TPA) می تواند در ۳ تا ۶ ساعت ابتدای سکته مغزی مفید باشد.
ناهماهنگی PWI & DWI می تواند نشان دهنده ناحیه penumbra باشد.
دیفیوژن غیر نرمال می تواند نشان دهنده ناحیه ای از بافت مغز باشد که در آن تخریب همراه با ادم سایتوتوکسیک و مرگ سلولی اتفاق افتاده است. ناحیه penumbra ناحیه ای است که در آن کاهش در CBFاتفاق افتاده ولی هنوز مرگ سلولی رخ نداده است
در جداول زیر نتایج به دست آمده از حالتهای مختلف DWI& PWI آمده است:

تخریب نورونی:
صرع :
مطالعات زیادی نیز بر روی پرفیوژن عروقی در بیماران مبتلا به صرع Epilepsyصورت گرفته .بررسی ها بیشتر بر روی جریان و حجم ناحیه مورد تهاجم بوده است. و بیانگر کاهش rCBV در هیپوکامپ سمت درگیر می باشد
منبع: گروه تلگرام Optimizing MRI Sequences
تهیه کننده : سرکار خانم صابری